Содержание
- 2. Изомерия комплексных соединений Изомерия – явление существования соединений, одинаковых по составу и мол. массе, но различающихся
- 3. Изомерия лигандов Связевая —NO2– и —ONO– нитро- нитрито- [Co(NH3)5NO2]2+ (желто-коричн.р-р) [Co(NH3)5ONO]2+ (розов.р-р) —NCS– и —SCN– тиоцианато-N
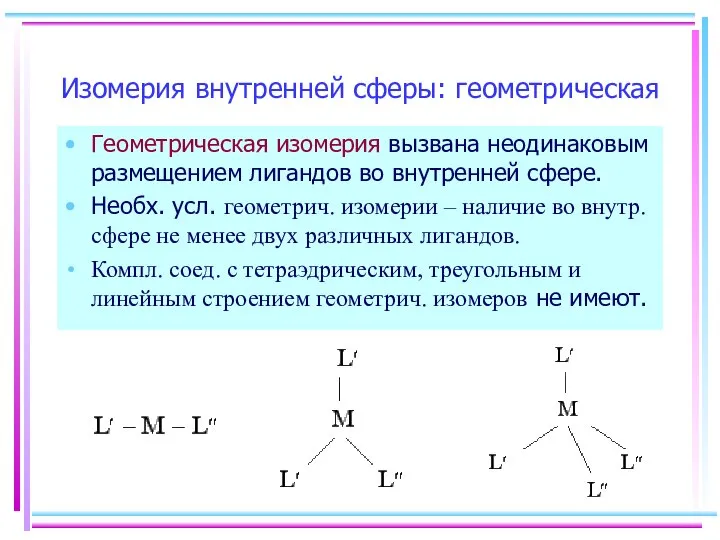
- 4. Изомерия внутренней сферы: геометрическая Геометрическая изомерия вызвана неодинаковым размещением лигандов во внутренней сфере. Необх. усл. геометрич.
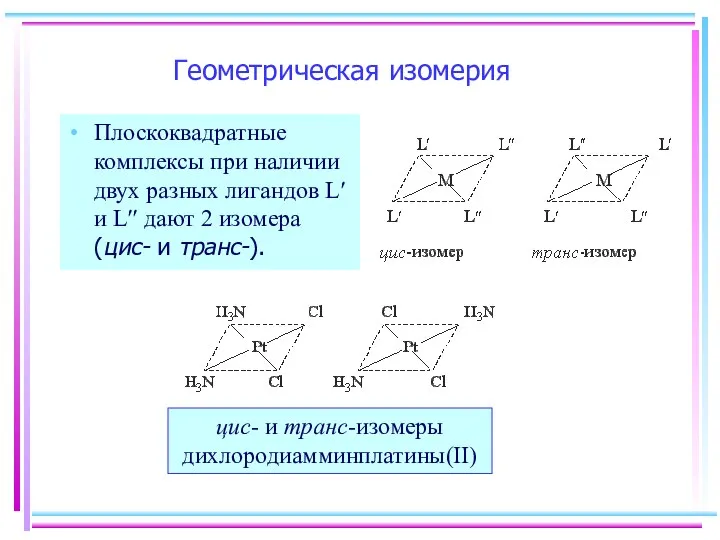
- 5. Геометрическая изомерия Плоскоквадратные комплексы при наличии двух разных лигандов L′ и L′′ дают 2 изомера (цис-
- 6. Геометрическая изомерия [ML′5L′′]: изомеров нет цис- и транс-изомеры дигидроксотетраамминкобальта(II)
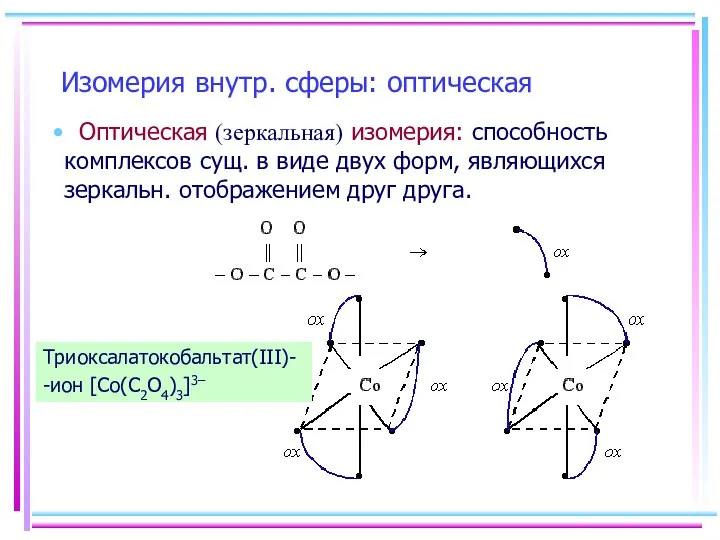
- 7. Изомерия внутр. сферы: оптическая Оптическая (зеркальная) изомерия: способность комплексов сущ. в виде двух форм, являющихся зеркальн.
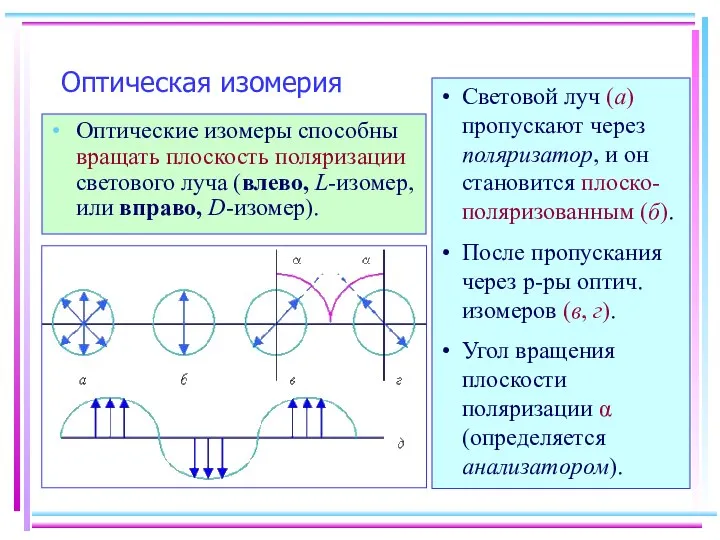
- 8. Оптическая изомерия Оптические изомеры способны вращать плоскость поляризации светового луча (влево, L-изомер, или вправо, D-изомер). Световой
- 9. Междусферная изомерия: 1) сольватная (гидратная); 2) ионная изомерия [Co(en)2Cl2]Cl · H2O [Co(H2O)(en)2Cl]Cl2 [Co(NH3)5I]SO4 [Co(NH3)5SO4]I 1 Cl–;
- 10. Междусферная изомерия Ионные (ионизационные) изомеры [Pt(NH3)4Cl2]Br2 и [Pt(NH3)4Br2]Cl2 [Pt(NH3)4SO4](OH)2 и [Pt(NH3)4(OH)2]SO4 pH >> 7 pH ≈
- 11. Квантовомеханические теории строения комплексных соединений Для объяснения строения комплексных соединений наиболее широко применяются теория валентных связей
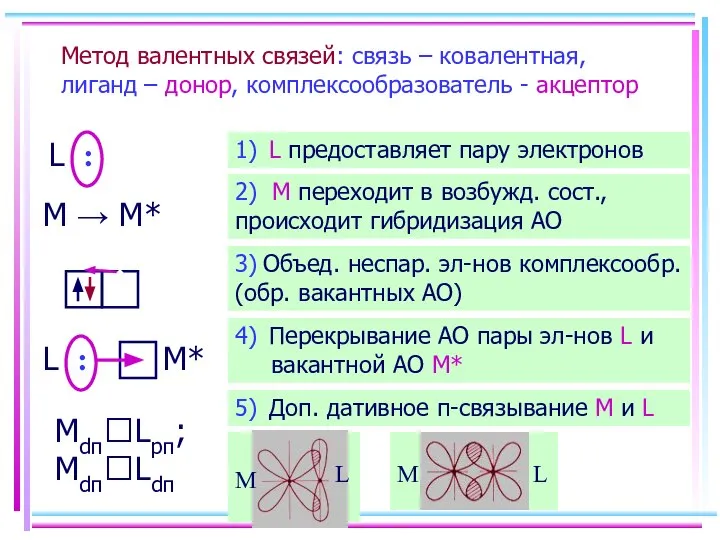
- 12. Метод валентных связей: связь – ковалентная, лиганд – донор, комплексообразователь - акцептор L : M →
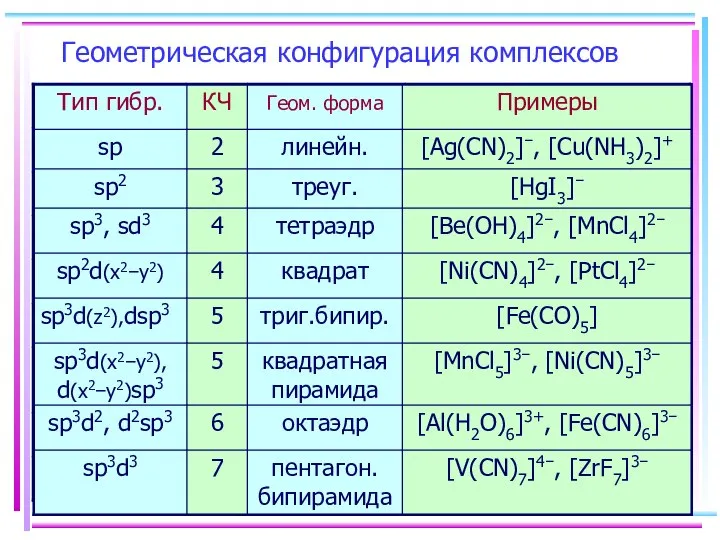
- 13. Геометрическая конфигурация комплексов
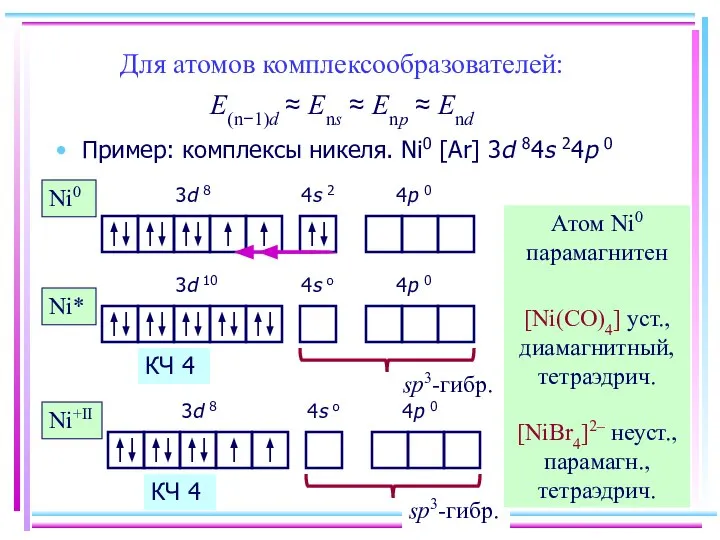
- 14. Для атомов комплексообразователей: E(n−1)d ≈ Ens ≈ Enp ≈ End Пример: комплексы никеля. Ni0 [Ar] 3d
- 15. Ni+II [Ni(CN)4]2– уст., диамагн., квадрат КЧ 4 [Ni(CN)5]3– уст., диамагн., квадратная пирамида КЧ 5 [Ni(H2O)6]2+, [Ni(NO2)6]4–
- 16. Fe+II [FeF6]4– уст., парамагн., октаэдр КЧ 6 Fe+II [Fe(CN)6]4– уст., диамагн., октаэдр КЧ 6
- 17. Основные положения теории кристаллического поля (поля лигандов) Связь комплексообразователя (центр. атома) M с лигандами L считается
- 18. В случае [ML6]ν±,0 : октаэдрическое поле лигандов Поле слабо влияет (энергия падает) в случае АО d(xy),
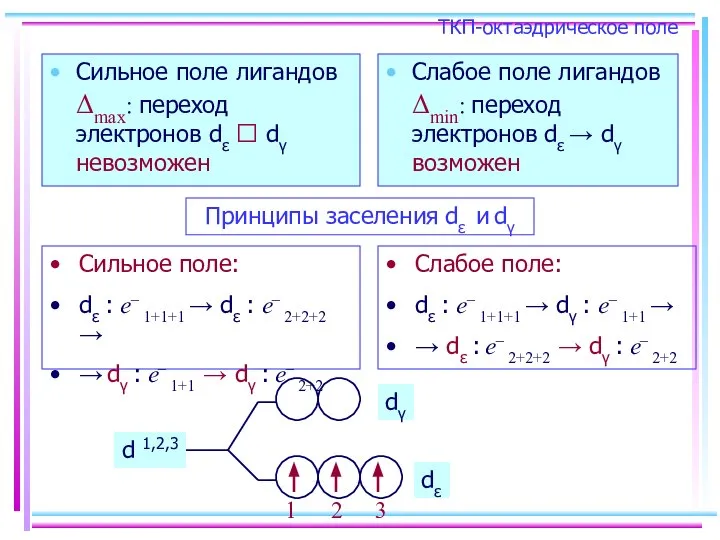
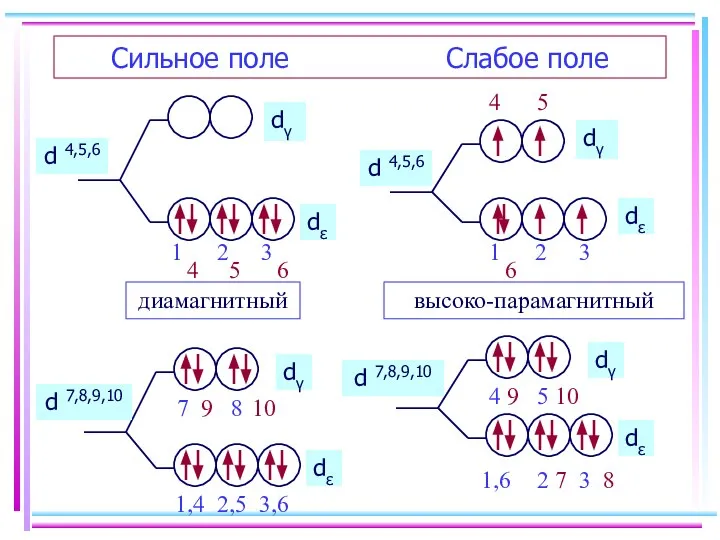
- 19. ТКП-октаэдрическое поле Сильное поле лигандов Δmax: переход электронов dε ⭲ dγ невозможен Слабое поле лигандов Δmin:
- 20. Сильное поле Слабое поле d 4,5,6 d 4,5,6 диамагнитный высоко-парамагнитный d 7,8,9,10 d 7,8,9,10
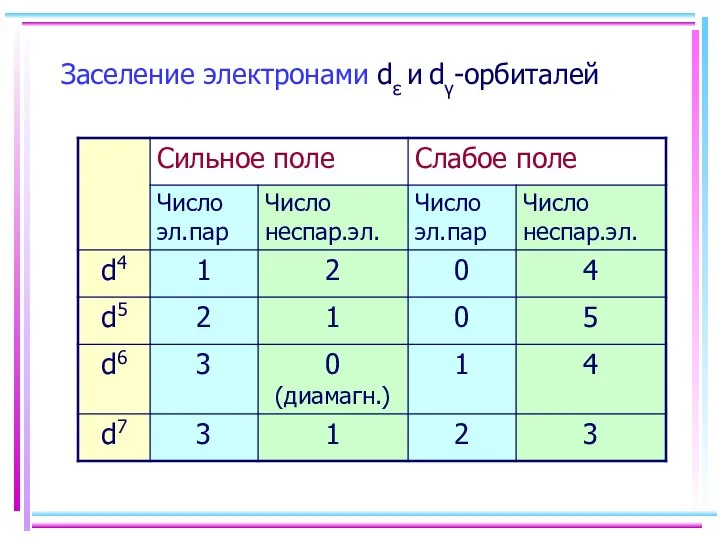
- 21. Заселение электронами dε и dγ-орбиталей
- 22. Лиганды сильного и слабого поля Спектрохимический ряд лигандов: Br – Fe+II: [Ar] 3d 64s 04p 0
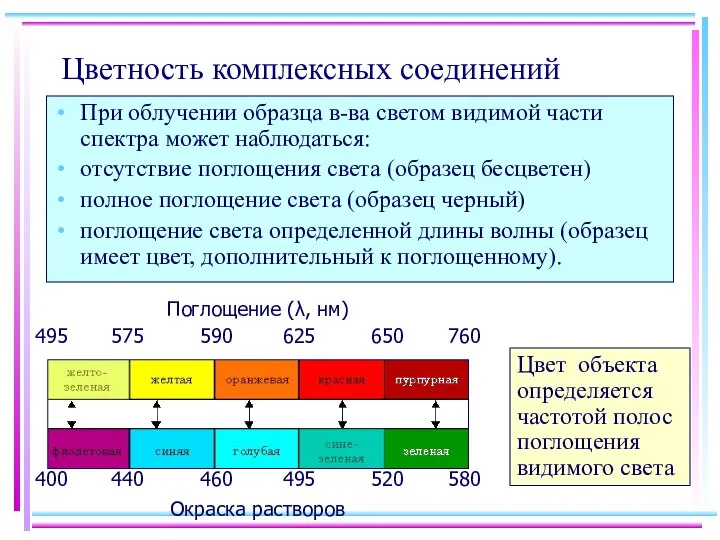
- 23. Цветность комплексных соединений При облучении образца в-ва светом видимой части спектра может наблюдаться: отсутствие поглощения света
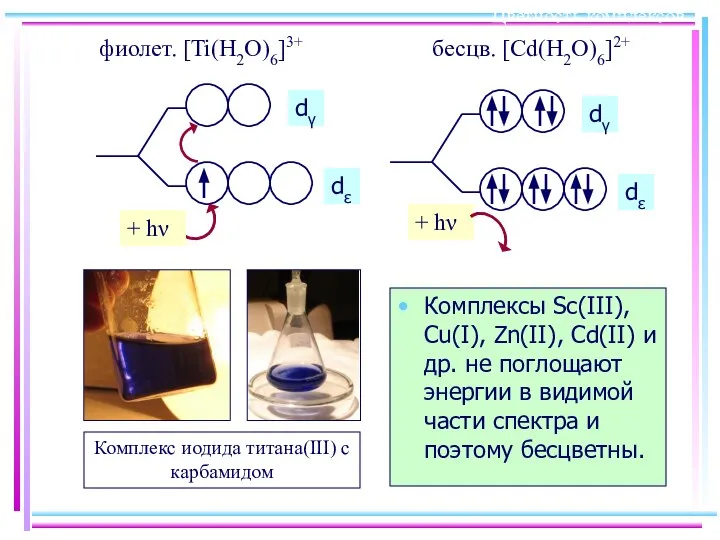
- 24. Цветность комплексов Комплексы Sc(III), Cu(I), Zn(II), Cd(II) и др. не поглощают энергии в видимой части спектра
- 26. Скачать презентацию

![Изомерия лигандов Связевая —NO2– и —ONO– нитро- нитрито- [Co(NH3)5NO2]2+ (желто-коричн.р-р) [Co(NH3)5ONO]2+ (розов.р-р)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1013058/slide-2.jpg)
![Геометрическая изомерия [ML′5L′′]: изомеров нет цис- и транс-изомеры дигидроксотетраамминкобальта(II)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1013058/slide-5.jpg)
![Междусферная изомерия: 1) сольватная (гидратная); 2) ионная изомерия [Co(en)2Cl2]Cl · H2O [Co(H2O)(en)2Cl]Cl2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1013058/slide-8.jpg)
![Междусферная изомерия Ионные (ионизационные) изомеры [Pt(NH3)4Cl2]Br2 и [Pt(NH3)4Br2]Cl2 [Pt(NH3)4SO4](OH)2 и [Pt(NH3)4(OH)2]SO4 pH](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1013058/slide-9.jpg)

![Ni+II [Ni(CN)4]2– уст., диамагн., квадрат КЧ 4 [Ni(CN)5]3– уст., диамагн., квадратная пирамида](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1013058/slide-14.jpg)
![Fe+II [FeF6]4– уст., парамагн., октаэдр КЧ 6 Fe+II [Fe(CN)6]4– уст., диамагн., октаэдр КЧ 6](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1013058/slide-15.jpg)

![В случае [ML6]ν±,0 : октаэдрическое поле лигандов Поле слабо влияет (энергия падает)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1013058/slide-17.jpg)
![Лиганды сильного и слабого поля Спектрохимический ряд лигандов: Br – Fe+II: [Ar]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1013058/slide-21.jpg)
 Карбоновые кислоты. Тест. 10 класс
Карбоновые кислоты. Тест. 10 класс Презентация на тему Неметаллы
Презентация на тему Неметаллы  Азотная кислота
Азотная кислота Расчет энергетического профиля реакции N,N,N’,N’-тетраметилгуанидина с о-метиленхиноном
Расчет энергетического профиля реакции N,N,N’,N’-тетраметилгуанидина с о-метиленхиноном Железо и его соединения
Железо и его соединения Изменения, происходящие с веществами. Физические явления в химии
Изменения, происходящие с веществами. Физические явления в химии Презентация на тему Общая характеристика галогенов
Презентация на тему Общая характеристика галогенов  Азотная кислота
Азотная кислота Структура к свойства веществ
Структура к свойства веществ Проектная работа по химии «Жидкий азот» Выполнили учащиеся 10Б класса Лобакин А. и Тумаков И.
Проектная работа по химии «Жидкий азот» Выполнили учащиеся 10Б класса Лобакин А. и Тумаков И. Периодический закон и строение атома
Периодический закон и строение атома Химия неорганическая и органическая
Химия неорганическая и органическая Лаборатория гидрометаллургических процессов
Лаборатория гидрометаллургических процессов Окислительно- восстановительные реакции
Окислительно- восстановительные реакции Химическая кинетика
Химическая кинетика Квантовая химия
Квантовая химия Х 9 Урок 7 Электролитическая диссоциация
Х 9 Урок 7 Электролитическая диссоциация Peek. Сферы применения
Peek. Сферы применения Век медный, бронзовый, железный
Век медный, бронзовый, железный Электролитическая диссоциация. Устойчивость комплексных соединений
Электролитическая диссоциация. Устойчивость комплексных соединений Молекулярная струйная печать
Молекулярная струйная печать строение атома
строение атома Сухой лёд
Сухой лёд Кислородосодержащие органические соединения. Cпирты (алканолы)
Кислородосодержащие органические соединения. Cпирты (алканолы) Периодический закон и периодическая система химических элементов. 11 класс
Периодический закон и периодическая система химических элементов. 11 класс Электрохимическая коррозия
Электрохимическая коррозия Презентация на тему Свойства черных и цветных металлов
Презентация на тему Свойства черных и цветных металлов  Курсовой синтез ацетоуксусного эфира
Курсовой синтез ацетоуксусного эфира