Содержание
- 2. СВАНТЕ АВГУСТ АРРЕНИУС. 1887
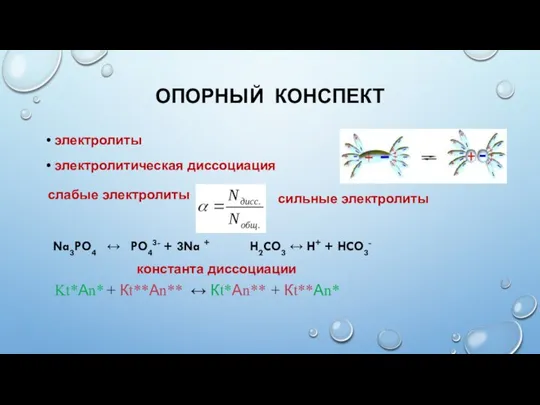
- 3. ОПОРНЫЙ КОНСПЕКТ электролиты электролитическая диссоциация слабые электролиты сильные электролиты Na3PO4 ↔ PO43- + 3Na + H2CO3
- 4. ОСНОВНЫЕ ПОЛОЖЕНИЯ ТЭД Электролиты – вещества, водные растворы которых проводят электрический ток. Электролитическая диссоциация – процесс
- 5. ОСНОВНЫЕ ПОЛОЖЕНИЯ ТЭД Электролиты у которых степень диссоциации низкая (менее 50%) называют слабыми электролитами. В растворах
- 6. ОСНОВНЫЕ ПОЛОЖЕНИЯ ТЭД При диссоциации рвутся химические связи, а значит степень диссоциации и константа диссоциации зависят
- 7. ОСНОВНЫЕ ПОЛОЖЕНИЯ ТЭД Процесс диссоциации изображается уравнением диссоциации . Для таких обратимых процессов можно записать константу
- 8. ДИССОЦИАЦИЯ МНОГООСНОВНЫХ КИСЛОТ И И ОСНОВАНИЙ МНОГОВАЛЕНТНЫХ МЕТАЛЛОВ ПРОИСХОДИТ СТУПЕНЧАТО. В РАСТВОРАХ ТАКИХ ВЕЩЕСТВ УСТАНАВЛИВАЮТСЯ НЕСКОЛЬКО
- 9. КОНСТАНТЫ ДИССОЦИАЦИИ
- 10. ОСНОВНЫЕ ПОЛОЖЕНИЯ ТЭД Закон разбавления Оствальда устанавливает зависимость между степенью диссоциации и концентрацией. Степень диссоциации увеличивается
- 11. ВЫПОЛНИТЕ ЗАДАНИЕ: ЗАПИШИТЕ ВЫРАЖЕНИЕ ДЛЯ КОНСТАНТЫ ДИССОЦИАЦИИ ПО ВСЕМ СТУПЕНЯМ. СРАВНИТЕ ЭТИ КОНСТАНТЫ ПО ВЕЛИЧИНЕ
- 12. ОСНОВНЫЕ ПОЛОЖЕНИЯ ТЭД К электролитам относятся соли, основания и кислоты. Все соли растворимые в воде –
- 13. СВОЙСТВА КИСЛОТ, ОСНОВАНИЙ И СОЛЕЙ В СВЕТЕ ТЭД Свойства солей, кислот и оснований можно и нужно
- 14. ЗАЧЕМ НАДО ЗНАТЬ ТЭД СТУДЕНТАМ-МЕДИКАМ? Жидкие среды организма содержат большое количество различных ионов. Постоянство концентраций различных
- 15. ДЛЯ ВСЕХ ЭЛЕКТРОЛИТОВ ЕСТЬ ФАКТИЧЕСКИ ОДНО ОБЩЕЕ ХИМИЧЕСКОЕ СВОЙСТВО, ОДИН ТИП РЕАКЦИЙ, В КОТОРЫЕ ОНИ ВСЕ
- 16. СУТЬ РЕАКЦИЙ ИОННОГО ОБМЕНА МОЖНО ПОНЯТЬ, ИСПОЛЬЗУЯ ИОННЫЕ УРАВНЕНИЯ РЕАКЦИЙ Реакции ионного обмена широко используются для
- 18. Алгоритм составления ионных уравнений: Составьте формулы электролитов, вступивших в реакцию ионного обмена и формулы продуктов реакции.
- 19. ВЫПОЛНИТЕ ЗАДАНИЯ: ЗАПИШИТЕ ИОННЫЕ УРАВНЕНИЯ РЕАКЦИЙ ОБМЕНА МЕЖДУ ЭТИМИ ЭЛЕКТРОЛИТАМИ. КАКИЕ ИЗ ЭТИХ ВЕЩЕСТВ БУДУТ ВЗАИМОДЕЙСТВОВАТЬ
- 20. КИСЛОТНО-ЩЕЛОЧНОЕ РАВНОВЕСИЕ В РАСТВОРАХ. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ ОТКРЫТОЕ КОМПЛЕКСНОЕ ЗАНЯТИЕ №13 ПО ТЕМЕ 1.5 «РАСТВОРЫ. ТЭД» ПРЕПОДАВАТЕЛЬ
- 21. АКТУАЛИЗАЦИЯ ОПОРНЫХ ЗНАНИЙ 1. ЧТО ТАКОЕ ЭЛЕКТРОЛИТЫ? КАКИЕ ВЕЩЕСТВА ОТНОСЯТСЯ К ЭЛЕКТРОЛИТАМ? 2. ПОЧЕМУ РАСТВОРЫ ЭЛЕКТРОЛИТОВ
- 22. ПРОТОННАЯ ТЕОРИЯ КИСЛОТ И ОСНОВАНИЙ Йоханнес-Николаус БРЁНСТЕД (1879 - 1947), датский физикохимик Томас-Мартин ЛАУРИ (1874 -
- 24. КИСЛОТНОСТЬ И ОСНОВНОСТЬ ВЕЩЕСТВ КИСЛОТНЫЕ И ОСНОВНЫЕ СВОЙСТВА ВЕЩЕСТВ ОПРЕДЕЛЯЮТСЯ СРОДСТВОМ К ПРОТОНУ, Т.Е. ЭНТАЛЬПИЕЙ РЕАКЦИИ
- 25. КИСЛОТА МОЖЕТ ОТДАТЬ ВОДОРОД, ЕСЛИ ЕСТЬ ЧАСТИЦА, СПОСОБНАЯ ЕГО ПРИНЯТЬ, Т.Е. ЕСТЬ ОСНОВАНИЕ. И НАОБОРОТ. ВЗАИМОДЕЙСТВИЕ
- 26. ЗНАЧЕНИЕ ВОДЫ ДЛЯ ПРОЯВЛЕНИЯ СВОЙСТВ КИСЛОТ И ОСНОВАНИЙ
- 27. ЕСЛИ ЭЛЕКТРОЛИТ ПРОЯВЛЯЕТ СВОЙСТВА И КИСЛОТ, И ОСНОВАНИЙ ИХ НАЗЫВАЮТ АМФОТЕРНЫМИ ИЛИ АМФОЛИТАМИ. ВОДА ЯВЛЯЕТСЯ ОЧЕНЬ
- 28. КИСЛОТНОСТЬ СРЕДЫ [H+] = [OH-] =10-7 МОЛЬ/Л – СРЕДА НЕЙТРАЛЬНАЯ [H+] > [OH-], ПРИ [H+] >10-7
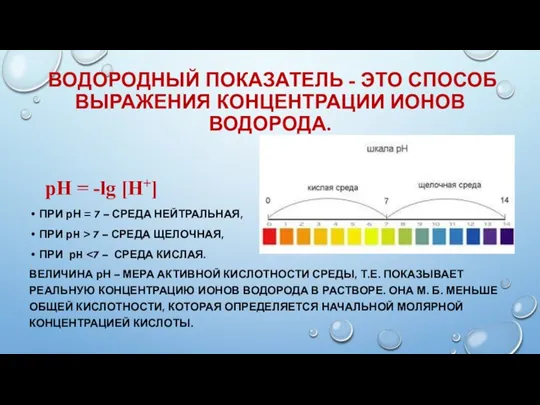
- 29. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ - ЭТО СПОСОБ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ ИОНОВ ВОДОРОДА. pН = -lg [H+] ПРИ рН =
- 30. ОПОРНЫЙ КОНСПЕКТ pН = -lg [H+]
- 31. ВЫПОЛНИТЕ ЗАДАНИЕ №1: ОПРЕДЕЛИТЕ С ПОМОЩЬЮ УНИВЕРСАЛЬНОЙ ИНДИКАТОРНОЙ БУМАГИ КОНЦЕНТРАЦИЮ ИОНОВ ВОДОРОДА В РАСТВОРЕ АЛГОРИТМ ОПУСТИТЬ
- 32. ВЫПОЛНИТЕ ЗАДАНИЕ №2: 1) ОПРЕДЕЛИТЕ ГДЕ КИСЛОТА, А ГДЕ ОСНОВАНИЕ? 2) КАКУЮ РОЛЬ В РЕАКЦИИ ИГРАЕТ
- 33. ВЫПОЛНИТЕ ЗАДАНИЕ №4: № 1 ВЫЧИСЛИТЕ ЧЕМУ РАВЕН рН РАСТВОРА 0,01МОЛЬ/Л НСL ? №2 В РАСТВОРЕ
- 34. ЗНАЧЕНИЕ рН ВНУТРЕННИХ СРЕД ОРГАНИЗМА ХАРАКТЕРИЗУЮТСЯ ЗНАЧИТЕЛЬНЫМ ПОСТОЯНСТВОМ, И ЭТО ПОСТОЯНСТВО ЯВЛЯЕТСЯ ОСНОВОЙ ГОМЕОСТАЗА КОНЦЕНТРАЦИЯ ИОНОВ
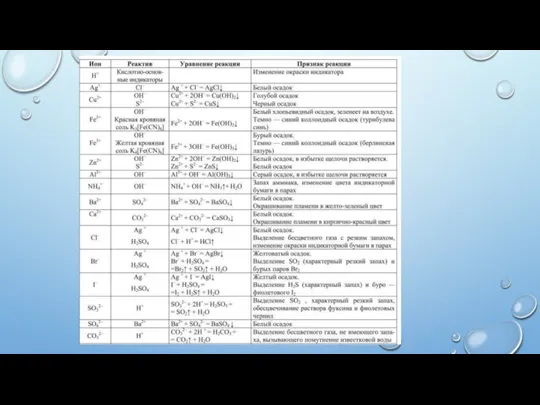
- 35. ВЫПОЛНИТЕ ЗАДАНИЕ №3: ЗАПОЛНИТЕ СВОБОДНЫЕ КЛЕТКИ В ТАБЛИЦЕ
- 36. КИСЛОТНО-ЩЕЛОЧНОЕ РАВНОВЕСИЕ (ПОСТОЯНСТВО рН) ОБЕСПЕЧИВАЕТСЯ РАБОТОЙ ВЫДЕЛИТЕЛЬНЫХ СИСТЕМ ОРГАНИЗМА (ПОЧКИ, ЛЕГКИЕ) И НАЛИЧИЕМ НЕСКОЛЬКИХ БУФЕРНЫХ СИСТЕМ,
- 37. НО … ЦЕНТРАЛЬНОЕ МЕСТО В СИСТЕМЕ РЕГУЛЯЦИИ рН ИГРАЮТ БУФЕРНЫЕ СИСТЕМЫ ОРГАНИЗМА РАСТВОРЫ, СОДЕРЖАЩИЕ СМЕСЬ СЛАБОГО
- 38. БУФЕРНЫЕ СИСТЕМЫ ОРГАНИЗМА БИКАРБОНАТНАЯ – ГЛАВНАЯ БУФЕРНАЯ СИСТЕМА ОРГАНИЗМА. ОНА СОСТОИТ ИЗ ДВУХ КИСЛОТНО-ОСНОВНЫХ ЧАСТЕЙ, НАХОДЯЩИХСЯ
- 39. НАРУШЕНИЕ КЩР ПОВЫШЕННАЯ КОНЦЕНТРАЦИЕЙ ИОНОВ Н+ - АЦИДОЗ ПОНИЖЕННОЙ КОНЦЕНТРАЦИЕЙ ИОНОВ Н+– АЛКАЛОЗ В БОЛЬШИНСТВЕ СЛУЧАЕВ,
- 40. ПРОТОЛИТИЧЕСКИЕ РЕАКЦИИ ЯСНО, ЧТО В РАСТВОРАХ КИСЛОТ, ГДЕ ПРЕОБЛАДАЮТ ИОНЫ ВОДОРОДА, СРЕДА КИСЛАЯ, А В РАСТВОРАХ
- 41. ГИДРОЛИЗ – ЭТО РЕАКЦИЯ ВЕЩЕСТВА С ВОДОЙ, ПРИ КОТОРОЙ ИСХОДНОЕ ВЕЩЕСТВО РАСПАДАЕТСЯ НА ДВА НОВЫХ ВЕЩЕСТВА
- 42. ГИДРОЛИЗ СОЛЕЙ ГИДРОЛИЗ СОЛЕЙ – РЕАКЦИЯ ВЗАИМОДЕЙСТВИЯ СОЛИ (СИЛЬНОГО ЭЛЕКТРОЛИТА) С ВОДОЙ (СЛАБЫМ ЭЛЕКТРОЛИТОМ), ЭТО ОБЫЧНАЯ
- 43. Как протекает процесс взаимодействия соли с водой?
- 44. Как протекает процесс взаимодействия соли с водой?
- 45. ПРАВИЛА ГИДРОЛИЗА: 1. СИЛЬНОЕ ПОБЕЖДАЕТ СЛАБОЕ 2. ПРИ ПОВЫШЕНИИ ТЕМПЕРАТУРЫ ГИДРОЛИЗ УСИЛИВАЕТСЯ (ПО ПРАВИЛУ ЛЕ ШАТЕЛЬЕ
- 46. ВОПРОСЫ И УПРАЖНЕНИЯ ПО ГИДРОЛИЗУ 1. НАПИШИТЕ РЕАКЦИИ МЕЖДУ А) ФОСФОРНОЙ КИСЛОТОЙ И ГИДРОКСИДОМ ЛИТИЯ Б)
- 49. Скачать презентацию























![КИСЛОТНОСТЬ СРЕДЫ [H+] = [OH-] =10-7 МОЛЬ/Л – СРЕДА НЕЙТРАЛЬНАЯ [H+] >](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/936757/slide-27.jpg)
![ОПОРНЫЙ КОНСПЕКТ pН = -lg [H+]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/936757/slide-29.jpg)

















 Презентация на тему Подгруппа азота
Презентация на тему Подгруппа азота  Введение в метаболизм
Введение в метаболизм Алкалоидтар. Алкалоидтарға жалпы сипаттама, жіктелуінің негізгі принциптері
Алкалоидтар. Алкалоидтарға жалпы сипаттама, жіктелуінің негізгі принциптері Химические свойства металлов. Электрохимический ряд напряжения металлов
Химические свойства металлов. Электрохимический ряд напряжения металлов Строение сплавов, диаграммы состояний
Строение сплавов, диаграммы состояний Электролиз
Электролиз Инструкция по самостоятельной подготовке к ЕГЭ (ЕРЭ) по химии 2022
Инструкция по самостоятельной подготовке к ЕГЭ (ЕРЭ) по химии 2022 ГАЛОГЕНЫ
ГАЛОГЕНЫ Сложные эфиры
Сложные эфиры Гелий. История открытия
Гелий. История открытия Цитология
Цитология Презентация по Химии "Введение в органическую химию в тезисах, аргументах и фактах"
Презентация по Химии "Введение в органическую химию в тезисах, аргументах и фактах"  Развитие творческих способностей у обучающихся на уроках химии
Развитие творческих способностей у обучающихся на уроках химии Электронные оболочки атомов
Электронные оболочки атомов Закономерности изменения свойств атомов химических элементов
Закономерности изменения свойств атомов химических элементов Периодическая система химических элементов Д. И. Менделеева
Периодическая система химических элементов Д. И. Менделеева Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Решение экспериментальных задач по теме Металлы
Решение экспериментальных задач по теме Металлы Соляная кислота и её соли
Соляная кислота и её соли Роль Хеуорса, Фишера, Лемье в изучении структуры углеводов
Роль Хеуорса, Фишера, Лемье в изучении структуры углеводов Презентация на тему Природные и синтетические красители и ароматизаторы
Презентация на тему Природные и синтетические красители и ароматизаторы  Все о пище с точки зрения химии
Все о пище с точки зрения химии Основы переработки нефти и нефтепродуктов
Основы переработки нефти и нефтепродуктов Этапы приготовления и микроскопического исследования нативного препарата осадка мочи
Этапы приготовления и микроскопического исследования нативного препарата осадка мочи Неметаллы. Агрегатные состояния неметаллов
Неметаллы. Агрегатные состояния неметаллов Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Безопасная пластмасса
Безопасная пластмасса Органическая химия
Органическая химия