Содержание
- 2. Для полного описания его движения используются 4 квантового числа: n = 1,2,3,... главное квантовое число и
- 3. Распределение электронов по орбиталям по 3 законам: 1) Принцип наименьшей энергии - в первую очередь электроны
- 4. Периодический закон (ПЗ) : свойства элементов и их однотипных соединений находятся в периодической зависимости от заряда
- 5. Основные характеристики атомов элементов. Радиус атома. - в пикометр (пм): 1 пм == 10-12 м. В
- 6. Химическая связь - это совокупность сил, связывающих атомы или молекулы друг с другом в новые устойчивые
- 7. К.с. может образоваться по обменному механизму (каждый из атомов на одну связь предоставляет по одному электрону)
- 8. Химическая связь, для которой характерно сильное взаимодействие общей электронной пары с ядром только одного из соединяемых
- 9. Металлическая связь. Металлы имеют особую кристаллическую решетку, в узлах которой находятся как атомы, так и катионы
- 10. Водородная связь может возникать между положительно поляризованным атомом водорода и отрицательно поляризованным атомом очень сильного неметалла
- 11. Квантово-механическое описание химической связи. Наибольшее распространение получили два способа - метод валентных связей (МВС) и метод
- 12. Метод молекулярных орбиталей (ММО) предполагает, что при образовании химической связи: а) атомы полностью утрачивают свою химическую
- 13. Диаграмма для молекулы Н2
- 14. По энергии рост :σ2S E 2p3 2s2 2s2 2p3 σ σ* σ σ* π π π*
- 15. E 2p3 2s2 2s2 2p3 σ σ* σ σ* π π π* π* O 1s22s22p4
- 17. Скачать презентацию
Слайд 2Для полного описания его движения используются 4 квантового числа:
n = 1,2,3,... главное
Для полного описания его движения используются 4 квантового числа:
n = 1,2,3,... главное

L - орбитальное квантовое число, принимающее значения 0, 1, 2, ... , (n-1), характеризует форму орбитали,
ml - магнитное квантовое число описывает направление орбитали в пространстве и принимает значения 0, ±1, ±2,...,± L.
спиновое число, которое описывает собственный момент иможет принимать лишь два значения: ±1/2
Слайд 3Распределение электронов по орбиталям по 3 законам:
1) Принцип наименьшей энергии -
Распределение электронов по орбиталям по 3 законам:
1) Принцип наименьшей энергии -

Порядок следования орбиталей по энергии определяется по правилам Клечковского :
1 правило Клечковского - меньшую энергию имеет та орбиталь, для которой меньше сумма (n+L);
2 правило Клечковского - если у двух орбиталей сумма (n+L) одинакова, то меньшую энергию имеет орбиталь с меньшим значением главного квантового числа) и составляет следующую последовательность
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f и т.д.
2) Принцип Паули - два электрона в одном атоме не могут иметь одинаковый набор из четырех квантовых чисел.
3) Правило Хунда – в пределах одного подуровня электроны распределяются по орбиталям таким образом, чтобы их суммарный спин был максимален.
Электронное строение атома записывается:
1. в электронной формуле указывается количество электронов на подуровнях атома: 1s2 2s2 2p6 3s2 3p6( Cl)
2) на энергетической диаграмме
Слайд 4Периодический закон (ПЗ) :
свойства элементов и их однотипных соединений находятся
Периодический закон (ПЗ) :
свойства элементов и их однотипных соединений находятся

ПЗ был создан Д. И. Менделеевым на основе разработанной им в 1867 г. период. Системы (таблицы).
ПС позволяет определить электронное строение внешних уровней атомов элементов и тем самым сразу выявить особенности, определяющие их химические свойства, т. е. способность отдавать или присоединять электроны.
Способность атома отдавать и присоединять электроны также зависит от
его радиуса и характеризуется величинами энергии ионизации, энергии сродства к электрону,
а в составе молекулы — относительной электроотрицательностью атома.
Энергия сродства к электрону (Еcр) - это энергия присоединения электрона атомом элемента с образованием аниона: Э + е- →Э- (Еср, кДж/моль).
Слайд 5Основные характеристики атомов элементов.
Радиус атома. - в пикометр (пм): 1 пм ==
Основные характеристики атомов элементов.
Радиус атома. - в пикометр (пм): 1 пм ==

Относительной электроотрицательностью (ОЭО) атома элемента называют величину, характеризующую относительную способность атома элемента притягивать к себе общие электроны в молекуле.
Энергия ионизации (Еи) - это энергия отрыва электрона от атома элемента с образованием катиона:
Э - е- →Э+ (Еи, кДж/моль).
Еи, достигающее максимума для атомов благородных газов, обладающих энергетически выгодной конфигурацией ns2np6.
Слайд 6Химическая связь - это совокупность сил, связывающих атомы или молекулы друг с
Химическая связь - это совокупность сил, связывающих атомы или молекулы друг с

. Энергия связи - энергия, выделяющаяся в процессе образования связи и характеризующая прочность этой связи (Есв, кДж/моль).
Химическая связь, осуществляемая за счет одной или нескольких электронных пар, сильно взаимодействующих с ядрами обоих соединяемых атомов, называется ковалентной связью (КС).
Для ковалентной связи характерно:
1) взаимодействие между двумя атомами, несильно отличающихся по электроотрицательности;
2) атомы обобществляют свои валентные электроны, путем образования общих электронных пар;
3) одна общая электронная пара между двумя атомами соответствует одной ковалентной связи;
4) при взаимодействии атомов, одинаковых по электроотрицательности, образуется неполярная ковалентная связь;
5) при взаимодействии атомов, различающихся по электроотрицательности, образуется полярная ковалентная связь;
Слайд 7К.с. может образоваться
по обменному механизму (каждый из атомов на одну связь
К.с. может образоваться
по обменному механизму (каждый из атомов на одну связь

или
по донорно-акцепторному механизму (донор предоставляет электронную пару, а акцептор - пустую валентную орбиталь).
Для к.с. Характерны:
: кратность, насыщаемость, направленность, сопряжение, полярность и поляризуемость.
Кратность ковалентной связи характеризуется числом общих электронных пар между соединяемыми атомами.
Насыщаемость- каждый атом в соединении способен образовывать определенное число ковалентных связей.
Направленность обусловлена тем, что атомные орбитали, участвующие в образовании молекулярных орбиталей, имеют различную форму и разную ориентацию в пространстве и стремятся к максимальному перекрыванию.
Молекулярная орбиталъ, в которой максимальная электронная плотность сосредоточена на прямой, соединяющей ядра атомов, называется δ-молекулярной орбиталью.
Молекулярная орбиталь, возникающая в результате бокового перекрывания р-орбиталей взаимодействующих атомов,, называется π -молекулярной орбиталью.
Л. Полинг предложил идею о гибридизации атомных орбиталей.
Гибридизацией называется гипотетический процесс смешения различного типа, но близких по энергии атомных орбиталей данного атома с возникновением того же числа новых (гибридных) орбиталей, одинаковых по энергии и форме.
Слайд 8Химическая связь, для которой характерно сильное взаимодействие общей электронной пары с ядром
Химическая связь, для которой характерно сильное взаимодействие общей электронной пары с ядром

И. с. не обладает насыщаемостью, т.к. один катион может притягивать все соседние анионы.
И с. ненаправленна, электрическое поле зарядов имеет сферическую симметрию.
Слайд 9Металлическая связь.
Металлы имеют особую кристаллическую решетку, в узлах которой находятся как
Металлы имеют особую кристаллическую решетку, в узлах которой находятся как

Особые свойства металлической связи (ненаправленность,
ненасыщаемость,
многоэлектронность
и многоцентровость) определяют ряд специфических физических свойств металлов и их сплавов: очень высокие значения тепло- и элекропроводности, большую пластичность, особые оптические свойства и т.д.
Слайд 10Водородная связь
может возникать между положительно поляризованным атомом водорода и отрицательно поляризованным
Водородная связь
может возникать между положительно поляризованным атомом водорода и отрицательно поляризованным

То, что подобное взаимодействие не обнаруживается у других атомов, обусловлено уникальными свойствами поляризованного атома водорода (малый размер, отсутствие внутренних электронных слоев).
Водородная связь (обозначена точками) может быть: а) межмолекулярной
Н ⎯ О⋅⋅⋅Н ⎯ О⋅⋅⋅ , H — F ...... H — F
Н Н
б) внутримолекулярной (между отдельными фрагментами молекулярной структуры).
Ряд важных физико-химических свойств молекулярных веществ определяется наличием в них водородных связей (температуры плавления и кипения, вязкость, плотность, растворимость).
Слайд 11Квантово-механическое описание химической связи.
Наибольшее распространение получили два способа - метод валентных связей
Квантово-механическое описание химической связи.
Наибольшее распространение получили два способа - метод валентных связей

Основные положения метода валентных связей (МВС):
1) в ходе химического взаимодействия атомы сохраняют свою физическую и химическую индивидуальность;
2) химическая связь рассматривается как возмущение, приводящее к понижению общей энергии взаимодействующих атомов при их сближении;
3) связь возникает при попарном перекрывании атомных орбиталей двух атомов;
4) связь обеспечивается наличием на перекрывшихся орбиталях пары электронов с антипараллельными спинами
5) атом может образовывать химические связи как в основном, так и в возбужденном валентном состоянии;
6) в возбужденное валентное состояние атом может перейти путем промотирования (переброса) валентных электронов с одних орбиталей на другие, если при этом:
а) увеличивается количество неспаренных электронов в атоме,
б) энергия, выделившаяся при образовании дополнительных связей
компенсирует энергию, затраченную на промотирование;
7) валентные орбитали при перекрывании могут подвергаться гибридизации,
Слайд 12Метод молекулярных орбиталей (ММО) предполагает, что при образовании химической связи:
а) атомы полностью
а) атомы полностью

б) электроны распределены по молекулярным орбиталям. Число МО на диаграмме равно числу исходных АО. МО могут быть 2 типов:
1) связывающие МО (СМО) характеризуются тем, что удаление с них электронов приводит к ослаблению химической связи в частице;
2) разрыхляющие МО (РМО) - удаление с них электронов приводит к увеличению энергии химической связи;
Электроны заполняют МО по тем же законам, что и АО в атомах:
а) принцип наименьшей энергии,
б) принцип Паули,
в) правило Хунда.
Критерием возможности существования химической частицы является порядок связи (ПС):
ПС = (Nсв - Nразр)/n ,
Если ПС > 0, то данная частица может существовать. Если ПС = 0 или ПС < 0, то такая частица существовать не может
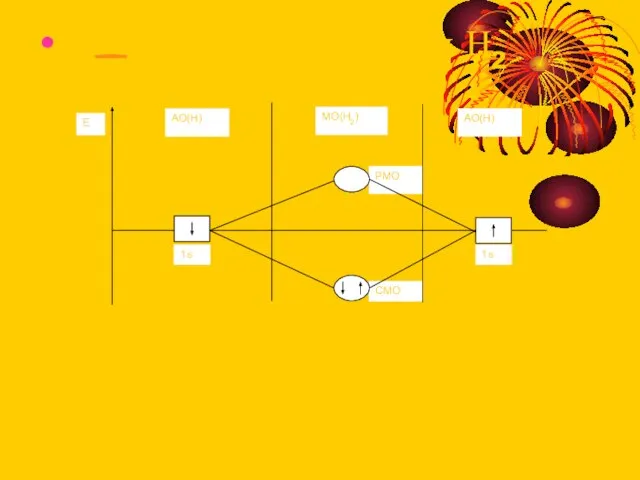
Слайд 13Диаграмма для молекулы Н2
Диаграмма для молекулы Н2
Слайд 14По энергии рост :σ2S < σ2S * < σpx <π pz= π
По энергии рост :σ2S < σ2S * < σpx <π pz= π
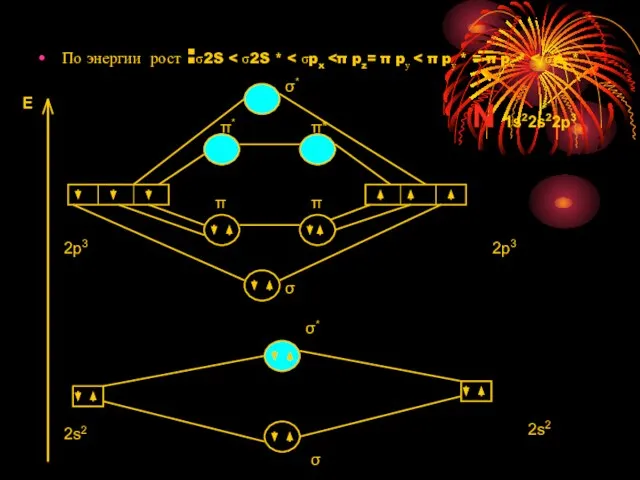
E
2p3
2s2
2s2
2p3
σ
σ*
σ
σ*
π
π
π*
π*
N 1s22s22p3
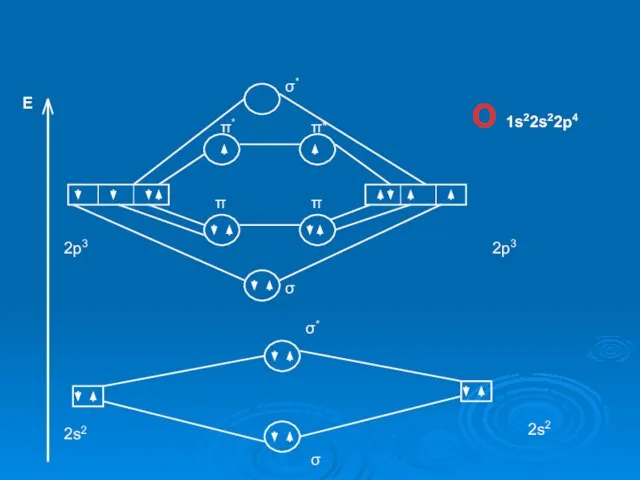
Слайд 15E
2p3
2s2
2s2
2p3
σ
σ*
σ
σ*
π
π
π*
π*
O 1s22s22p4
E
2p3
2s2
2s2
2p3
σ
σ*
σ
σ*
π
π
π*
π*
O 1s22s22p4
 Сера. Немного истории
Сера. Немного истории тэд — без анимации(1)
тэд — без анимации(1) Распространение ПВО в приземном слое атмосферы
Распространение ПВО в приземном слое атмосферы Возможности пропедевтического курса химии
Возможности пропедевтического курса химии Амины
Амины Презентация на тему Оксиды. Основания. Кислоты
Презентация на тему Оксиды. Основания. Кислоты  Взаимодействие частиц конденсированной фазы, их срастание (коалесценция). Лекция 3
Взаимодействие частиц конденсированной фазы, их срастание (коалесценция). Лекция 3 Гидролиз солей
Гидролиз солей Неметаллы. Общая характеристика
Неметаллы. Общая характеристика Общие знания по курсу неорганической химии
Общие знания по курсу неорганической химии Предмет органической химии
Предмет органической химии Металлы тоже воевали… 8 класс
Металлы тоже воевали… 8 класс Переработка нефти
Переработка нефти Разбор заданий
Разбор заданий Составление химических формул методом нулевой суммы
Составление химических формул методом нулевой суммы Составление уравнений окислительно-восстановительных реакций
Составление уравнений окислительно-восстановительных реакций Алкадиены. Строение. Изомерия. Свойства
Алкадиены. Строение. Изомерия. Свойства Карбонильные соединения – альдегиды
Карбонильные соединения – альдегиды Закономерности процессов тепло- и газообмена на пожаре
Закономерности процессов тепло- и газообмена на пожаре Педагогические измерительные материалы ХИМИЯ Варганова Ирина Вячеславовна, и.о. зав. кафедрой естественно-математических дисцип
Педагогические измерительные материалы ХИМИЯ Варганова Ирина Вячеславовна, и.о. зав. кафедрой естественно-математических дисцип Характеристика переходного элемента на основании его положения в периодической системе Д.И. Менделеева
Характеристика переходного элемента на основании его положения в периодической системе Д.И. Менделеева Презентация на тему Угольная кислота и её соли (9 класс)
Презентация на тему Угольная кислота и её соли (9 класс)  Золото
Золото Смеси веществ
Смеси веществ Химический тренажер
Химический тренажер Вебинар. Задачи из домашек по 27-29 задачам
Вебинар. Задачи из домашек по 27-29 задачам Металлы
Металлы Окислительно-восстановительные реакции, 9 класс
Окислительно-восстановительные реакции, 9 класс