Содержание
- 2. ЦЕЛЬ ИЗУЧЕНИЯ МАТЕРИАЛА Дать понятия: степени окисления элементов в простых и сложных веществах; о восстановителях и
- 3. СОДЕРЖАНИЕ Окислительно-восстановительные реакции (ОВР) Степень окисления. Правила расчета степени окисления Основные понятия Окислительно-восстановительные свойства соединений Составление
- 4. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ (ОВР) Два типа химических реакций реакции обмена ─ реакции, протекающие без изменения степеней окисления
- 5. СТЕПЕНЬ ОКИСЛЕНИЯ Габдуллин А.Н., Никоненко Е.А. Окислительно-восстановительные реакции
- 6. ВЫСШАЯ И НИЗШАЯ СТЕПЕНИ ОКИСЛЕНИЯ МЕТАЛЛОВ Номер группы в периодической системе равен числу валентных электронов атома
- 7. ВЫСШАЯ И НИЗШАЯ СТЕПЕНИ ОКИСЛЕНИЯ НЕМЕТАЛЛОВ Высшая степень окисления неметаллов равна номеру группы (исключение составляют кислород
- 8. ПРАВИЛА РАСЧЕТА СТЕПЕНИ ОКИСЛЕНИЯ Габдуллин А.Н., Никоненко Е.А. Окислительно-восстановительные реакции
- 9. С.о. в сложных веществах: атомов элементов IA подгруппы +1 (Na+, K+); IIA подгруппы +2 (Be+2, Mg+2,
- 10. ПРИМЕРЫ РАСЧЕТА СТЕПЕНИ ОКИСЛЕНИЯ Расчет с. о. хлора в хлорате калия KClO4 Степень окисления кислорода −2
- 11. ОСНОВНЫЕ ПОНЯТИЯ Восстановитель (Red) − частица (атом, молекула, ион), которая отдает электроны. Окислитель (Ox) – частица
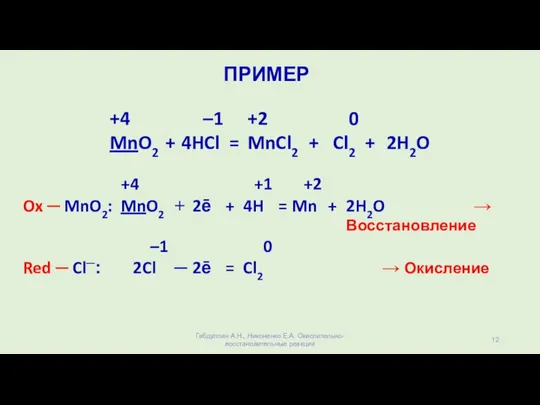
- 12. ПРИМЕР Габдуллин А.Н., Никоненко Е.А. Окислительно-восстановительные реакции
- 13. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА СОЕДИНЕНИЙ Габдуллин А.Н., Никоненко Е.А. Окислительно-восстановительные реакции
- 14. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА СОЕДИНЕНИЙ Только восстановителями являются: металлы: Na0, Ca0, Al0, Fe0… простые отрицательно заряженные ионы: Cl−,
- 15. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА СОЕДИНЕНИЙ Габдуллин А.Н., Никоненко Е.А. Окислительно-восстановительные реакции
- 16. СОСТАВЛЕНИЕ УРАВНЕНИЙ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ Для реакций, протекающих в растворах электролитов, используют метод электронно-ионного баланса: количество отданных
- 17. СОСТАВЛЕНИЕ УРАВНЕНИЙ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ Электронно-ионная схема: 2 Al0 ─ 3ē = Al3+ 3 2H+ + 2ē
- 18. ОВР В КИСЛОЙ СРЕДЕ Как правило, кислая среда создается добавлением разбавленной H2SO4: K2Cr2O7 + Na2SO3 +
- 19. ОВР В КИСЛОЙ СРЕДЕ Рассчитываем степени окисления атомов элементов, которые ее изменяют. Определяем окислитель (Ox) и
- 20. ОВР В КИСЛОЙ СРЕДЕ Записываем схемы переходов: Уравниваем число атомов элементов, изменяющих степень окисления и указываем
- 21. Cr2O72–+ 3SO32– + 14Н+ + 3Н2О → 2Cr3+ + 3SO42– + 6Н+ + 7Н2О Cr2O72–+ 3SO32–
- 22. ОВР В ЩЕЛОЧНОЙ СРЕДЕ Обычно среда создается добавлением гидроксида натрия или калия. В растворе присутствуют ионы
- 23. ПРИМЕР ОВР В ЩЕЛОЧНОЙ СРЕДЕ 2CrO2– + ClO3–+ 8ОН– + 3Н2О = 2CrO42– + Cl– +
- 24. ОВР В НЕЙТРАЛЬНОЙ СРЕДЕ В нейтральной среде недостающие атомы кислорода и водорода в левой части полуреакций
- 25. 3Mn2+ + 2MnO4─ + 10Н2О = 5MnO2 + 12Н+ + 8ОН– 8Н2О + 4H+ ПРИМЕР ОВР
- 26. ПРАВИЛА ИСПОЛЬЗОВАНИЯ СРЕДЫ Габдуллин А.Н., Никоненко Е.А. Окислительно-восстановительные реакции
- 27. ВЫВОДЫ Окислительно-восстановительные реакции − реакции, в которых изменяются степени окисления атомов элементов, входящих в состав реагирующих
- 28. ВЫВОДЫ Для вывода коэффициентов в уравнениях ОВР, протекающих в кислой, щелочной и нейтральной средах, используют метод
- 30. Скачать презентацию


























 Неорганическая и органическая химия
Неорганическая и органическая химия Химические явления
Химические явления Строение и физические свойства металлов
Строение и физические свойства металлов Презентация на тему Электрохимический ряд напряжений металлов
Презентация на тему Электрохимический ряд напряжений металлов  Кинетика химических и биохимических процессов. Часть 1
Кинетика химических и биохимических процессов. Часть 1 Общая характеристика металлов
Общая характеристика металлов Prezentatsia_lektsia_Reaktora_2_Materialny_balans
Prezentatsia_lektsia_Reaktora_2_Materialny_balans Химия. Электролитическая диссоциация. (9 класс)
Химия. Электролитическая диссоциация. (9 класс) Ионная связь
Ионная связь Образовательные технологии, используемые на уроках химии для повышения мотивации обучения
Образовательные технологии, используемые на уроках химии для повышения мотивации обучения Что такое электрон?
Что такое электрон? Практическая работа 1. ХТП. Классификация химических реакций
Практическая работа 1. ХТП. Классификация химических реакций Алкены. Гомологический ряд алкенов. Изомерия алкенов. Химические свойства алкенов
Алкены. Гомологический ряд алкенов. Изомерия алкенов. Химические свойства алкенов Презентация на тему Привычная и удивительная поваренная соль
Презентация на тему Привычная и удивительная поваренная соль  Презентация1
Презентация1 Будова електронних оболонок і властивості хіиічних елементів. (8 клас)
Будова електронних оболонок і властивості хіиічних елементів. (8 клас) Спирты и их производные
Спирты и их производные Турнир смекалистых. Все о кислотах
Турнир смекалистых. Все о кислотах Номенклатура алканов разветвленного строения
Номенклатура алканов разветвленного строения Теория химического строения А. М. Бутлерова
Теория химического строения А. М. Бутлерова Предельные углеводороды. Алканы, насыщенные углеводороды, парафины, циклоалканы
Предельные углеводороды. Алканы, насыщенные углеводороды, парафины, циклоалканы Классификация загрязняющих веществ по фазово-дисперсному составу
Классификация загрязняющих веществ по фазово-дисперсному составу ТЕМА: БОЛЬШОЙ КРУГОВОРОТ ВЕЩЕСТВ
ТЕМА: БОЛЬШОЙ КРУГОВОРОТ ВЕЩЕСТВ Свойства воды
Свойства воды Массообменные процессы
Массообменные процессы Солевые кристаллы
Солевые кристаллы Оксиды. Физические свойства
Оксиды. Физические свойства Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота
Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота