Содержание
- 2. Ионная связь: Рассмотрим пример образования бинарной ионной связи на примере хлорида натрия NaCl. Атом натрия передал
- 3. Ковалентная полярная связь: Прочитать и вспомнить
- 4. Степень окисления: Проанализировать по прочитанному на 2 предыдущих слайдах:
- 5. Степень окисления – условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все
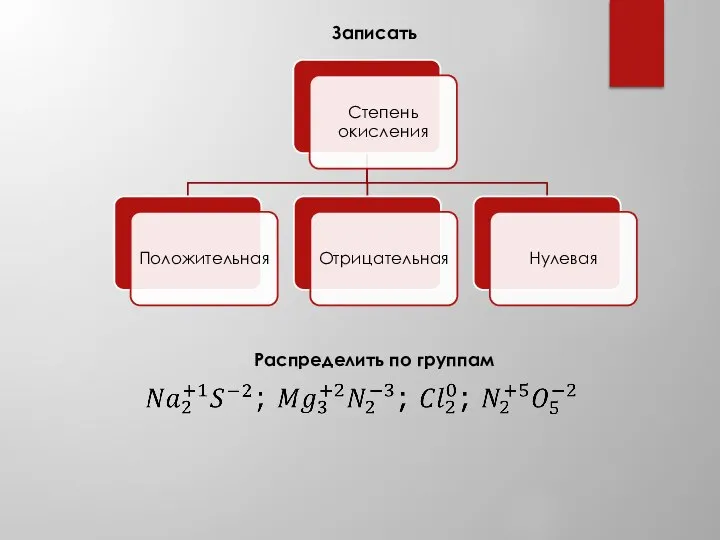
- 6. Записать Распределить по группам
- 7. Степень окисления: Отрицательное значение степени окисления имеют те атомы, которые приняли электроны от других атомов или
- 8. Отрицательная степень окисления: Записать
- 9. Степень окисления: Положительную степень окисления имеют те атомы, которые отдают свои электроны другим атомам или от
- 10. Положительная степень окисления: Степень окисления в соединениях с металлами: Степень окисления в соединениях с водородом: Записать
- 11. Нулевая степень окисления: Нулевую степень окисления имеют атомы простых веществ (ковалентная неполярная связь) и атомы в
- 12. Понятие валентность и степень окисления: Понятия степень окисления и валентность не одно и то же. Записать
- 13. Записать
- 14. Запиши правила определения степеней окисления (с.о.) 1) Степень окисления простых веществ и свободных атомов равна нулю
- 15. 4) Постоянные степени окисления: H +1 (кроме гидридов активных металлов, например:Na+1H-1) O-2 (кроме O+2F2, H2O2-1,пероксидов металлов)
- 16. Правило креста Правило креста: для составления химических формул по названию вещества надо записать соответствующие знаки химических
- 17. Алгоритм для составления формулы вещества: Записать знаки химических элементов рядом (сначала записывается менее электроотрицательный элемент). Определить
- 18. Составим формулу соединения карбида алюминия: Посмотреть пример
- 19. Составим формулу соединения оксида алюминия (III): Посмотреть пример 2
- 20. Название бинарных соединений: Записать
- 21. Составление формул по степени окисления Оксид натрия - Хлорид железа (III) - Нитрид магния - Оксид
- 23. Скачать презентацию



















 Средства для мытья окон
Средства для мытья окон Алканы. Этан
Алканы. Этан Изучение свойств азотной кислоты для учащихся 9 классов
Изучение свойств азотной кислоты для учащихся 9 классов Строение вещества. Эксперименты
Строение вещества. Эксперименты Моющие и чистящие средства
Моющие и чистящие средства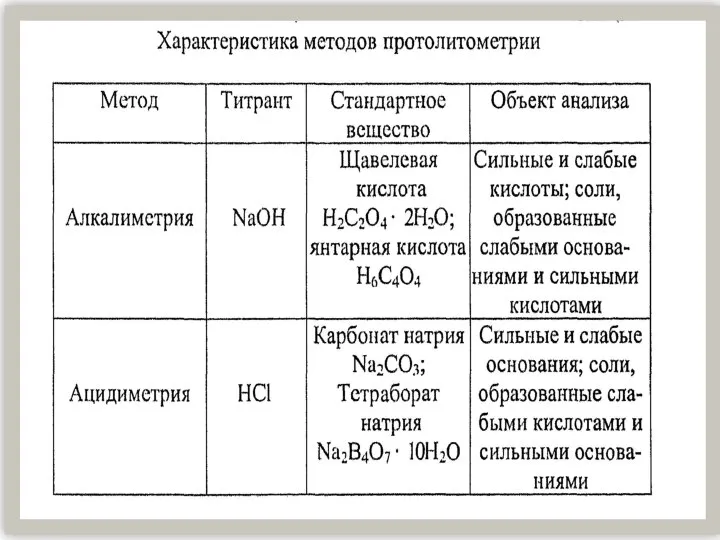 Характеристика методов протолитометрии
Характеристика методов протолитометрии Презентация на тему Расчеты по химическим уравнениям
Презентация на тему Расчеты по химическим уравнениям  Неметаллы. Агрегатные состояния неметаллов
Неметаллы. Агрегатные состояния неметаллов Чистые вещества и смеси
Чистые вещества и смеси Сухой лёд
Сухой лёд Химические реакции
Химические реакции Невидиме чорнило
Невидиме чорнило Гидрокрекинг нефтяного сырья
Гидрокрекинг нефтяного сырья Распространение ПВО в приземном слое атмосферы
Распространение ПВО в приземном слое атмосферы Аналитические методы в современных исследованиях химии
Аналитические методы в современных исследованиях химии Количество вещества - моль
Количество вещества - моль Шаблон для презентации по химии
Шаблон для презентации по химии Истина - дочь времени, а не авторитета
Истина - дочь времени, а не авторитета Железо
Железо Анализ объектов окружающей среды. Сопоставление и выбор методов анализа
Анализ объектов окружающей среды. Сопоставление и выбор методов анализа Выбор материала для изготовления зубчатых колес
Выбор материала для изготовления зубчатых колес ОСОБЕННОСТИ СТРОЕНИЯ, РЕАКЦИОННОЙ СПОСОБНОСТИ И МЕТОДЫ СИНТЕЗА АЛКИНОВ
ОСОБЕННОСТИ СТРОЕНИЯ, РЕАКЦИОННОЙ СПОСОБНОСТИ И МЕТОДЫ СИНТЕЗА АЛКИНОВ Химические методы. Золь-гель метод
Химические методы. Золь-гель метод ЭОР в преподавании химии
ЭОР в преподавании химии Алкины
Алкины Ароматические углеводороды (арены)
Ароматические углеводороды (арены) Ароматические углеводороды - Арены
Ароматические углеводороды - Арены Соединения щелочноземельных металлов
Соединения щелочноземельных металлов