Содержание
- 2. Давать определение понятиям: растворитель, растворимое вещество, раствор. 2. Давать определение понятию массовая доля растворенного вещества. 3.Характеризовать
- 3. Старайся дать уму как можно больше пищи. Л. Толстой.
- 4. Вопрос 1 Вопрос 2 Вопрос 3 Вопрос 4 Вопрос 5 Вопрос 6 Вопрос 7 Вопрос 8
- 5. Раствор- это однородная смесь, состоящая из растворителя , растворенного вещества и продуктов их взаимодействия Что такое
- 6. Виды растворов Ненасыщенные растворы растворы в которых вещество еще может растворяться при данной температуре Насыщенные растворы
- 7. Виды растворов Разбавленные - содержат мало растворенного вещества и много растворителя Концентрированные -содержат много растворенного вещества
- 8. Растворитель- это вещество, в котором равномерно распределены частицы растворенного вещества. Чаще всего – жидкое (вода) Что
- 9. Растворенное вещество – это вещество, равномерно распределенное в растворителе. Растворенное в-во может быть: жидким - спирт,
- 10. Классификация веществ по растворимости Хорошо растворимые вещества (в 100г воды растворяется > 1г вещества) Малорастворимые (в
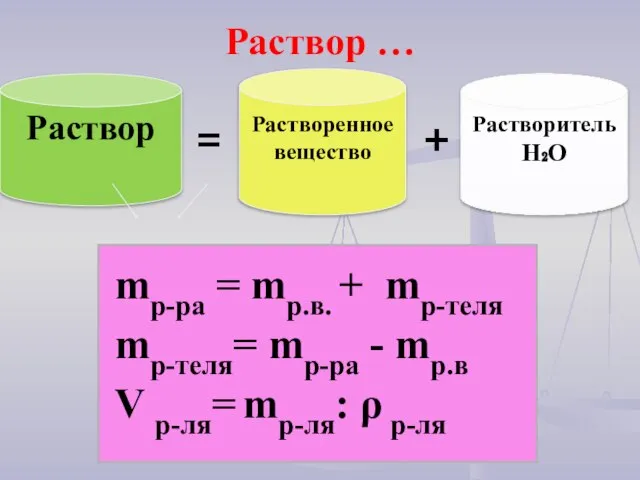
- 11. Раствор … mр-ра = mр.в. + mр-теля mр-теля= mр-ра - mр.в V р-ля= mр-ля: ρ р-ля
- 12. Что означает 9%-ый раствор? В 100г раствора содержится 9г вещества и 91г воды 9%- это процентная
- 13. NB!Массовая доля растворенного в-ва - обозначается ω ( омега) и называется процентной концентрацией раствора. Выражается в
- 14. Задание № 3. Найди ошибку: 15 % р-р – это 10 г р.в-ва и 90 г
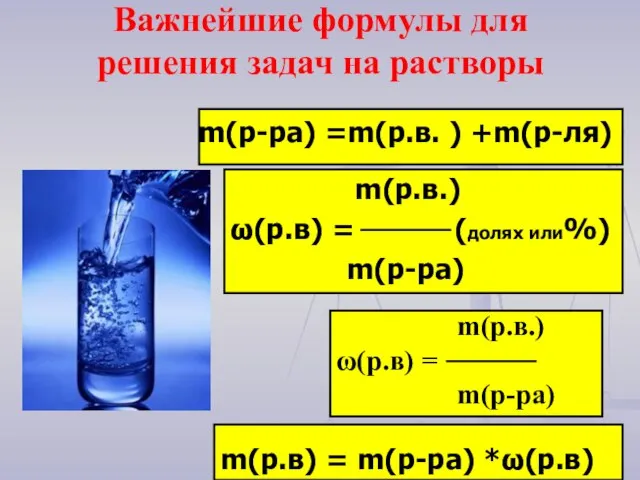
- 15. m(р-ра) =m(р.в. ) +m(р-ля) m(р.в.) ω(р.в) = (долях или%) m(р-ра) m(р.в.) ω(р.в) = m(р-ра) Важнейшие формулы
- 17. Реши задачи Задача №1. Какова массовая доля соли в растворе, полученном при растворении 20 г соли
- 18. Решение: 1. Рассчитаем m(р-ра) m(р-ра) =m(р.в. ) +m(р-ля) m(р-ра) =20г +180г = 200г 2. Запишем формулу
- 19. Задача №2. В 800г раствора содержится 40г поваренной соли. Какова массовая доля соли в растворе? Дано:
- 20. Приготовление растворов. Задача №3. Для полоскания горла используют 4% раствор соды (NaHCO3). Приготовить 50 г 4%-ного
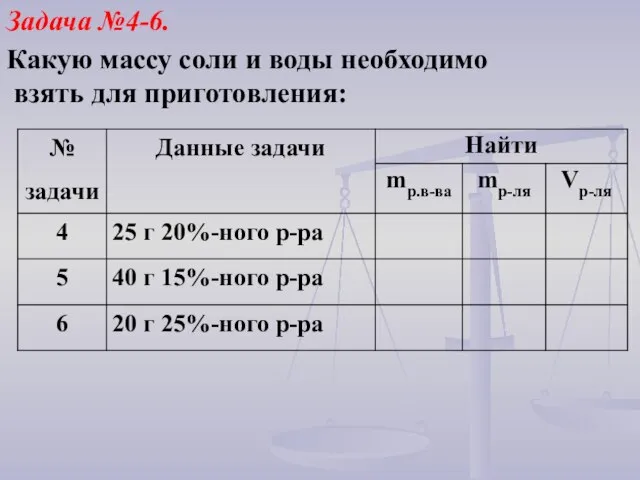
- 21. Задача №4-6. Какую массу соли и воды необходимо взять для приготовления:
- 22. Рефлексия 1.На уроке я работал… 2.Своей работой на уроке я… 3.Урок для меня показался… 4.За урок
- 24. Скачать презентацию

















 Фотохромные биоматериалы. Применение спиропирановых систем в медицине
Фотохромные биоматериалы. Применение спиропирановых систем в медицине Классы неорганических веществ
Классы неорганических веществ Презентация на тему Важнейшие классы неорганических соединений
Презентация на тему Важнейшие классы неорганических соединений  Альдегиды. Номенклатура, изомерия. Получение альдегидов
Альдегиды. Номенклатура, изомерия. Получение альдегидов Получение галогенов. Биологическое значение и применение галогенов и их соединений. (1)
Получение галогенов. Биологическое значение и применение галогенов и их соединений. (1) Пластик и его применение в быту
Пластик и его применение в быту Особенности решения практикоориентированного задания №26 ГИА-11
Особенности решения практикоориентированного задания №26 ГИА-11 Химическое равновесие
Химическое равновесие Массовая доля элемента в веществе
Массовая доля элемента в веществе Техника безопасности на уроках химии
Техника безопасности на уроках химии Условия, замедляющие выход водорастворимых питательных веществ из удобрений на примере аммофоса
Условия, замедляющие выход водорастворимых питательных веществ из удобрений на примере аммофоса Применение неорганических соединений в пищевой промышленности
Применение неорганических соединений в пищевой промышленности Превращения веществ
Превращения веществ Основания и их свойства
Основания и их свойства Сфера влияния химии
Сфера влияния химии Про задачи. Химия 11 класс
Про задачи. Химия 11 класс Урок №10 12 класс
Урок №10 12 класс Спирты
Спирты Вероятность протекания химических реакций
Вероятность протекания химических реакций Судың химиялық потенциялы
Судың химиялық потенциялы Бытовая химия
Бытовая химия Проект по химии. Минералы на нашей коже
Проект по химии. Минералы на нашей коже Типы изомерии
Типы изомерии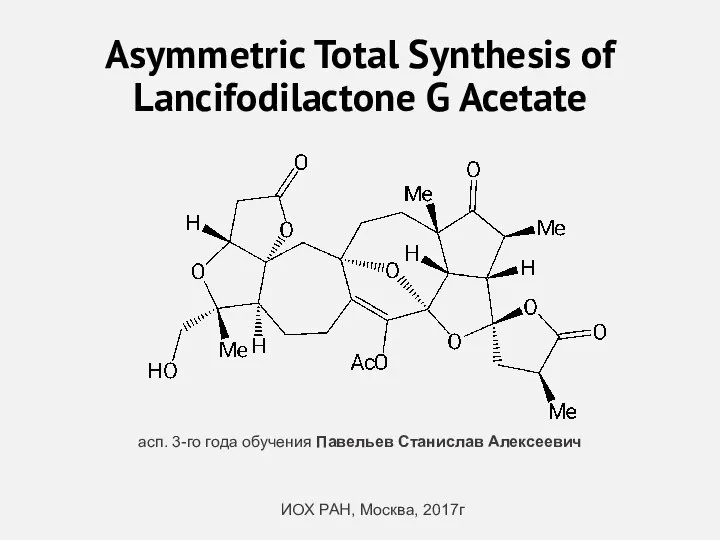 Asymmetric Total Synthesis of Lancifodilactone G Acetate
Asymmetric Total Synthesis of Lancifodilactone G Acetate атомно-молекулярное учение (1)
атомно-молекулярное учение (1) Марказит (лучистый колчедан, капельное серебро)
Марказит (лучистый колчедан, капельное серебро)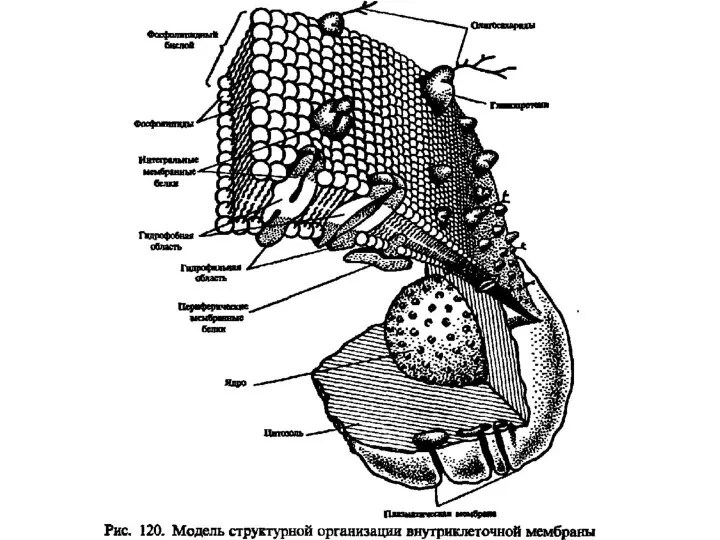 Липиды. Классификация липидов
Липиды. Классификация липидов Уравнения химических реакций
Уравнения химических реакций