Содержание
- 2. Физические свойства газ, без цвета, без запаха, без вкуса, практически нерастворим в воде; t0пл. -259,10 С;
- 3. Осторожно: ВОДОРОД! Смесь водорода с одним объемом кислорода – гремучий газ Смесь водорода и воздуха –
- 4. Химические свойства Взаимодействие с простыми веществами Взаимодействие со сложными веществами
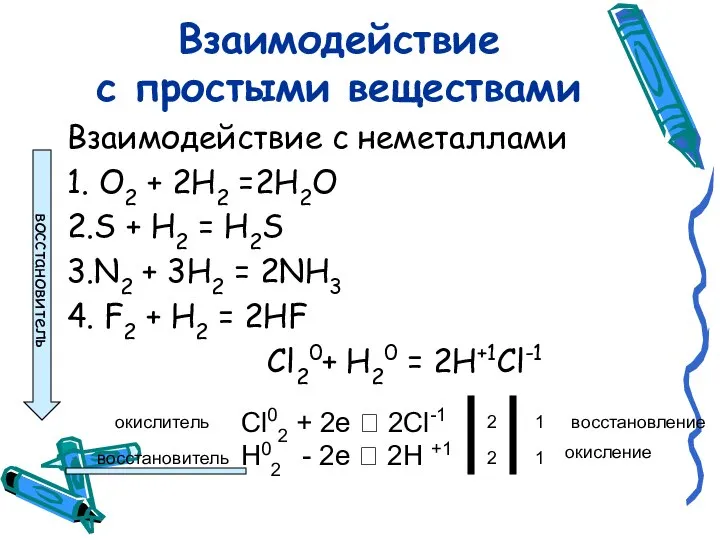
- 5. Взаимодействие с простыми веществами Взаимодействие с неметаллами 1. O2 + 2H2 =2Н2О 2.S + H2 =
- 6. Взаимодействие с простыми веществами Взаимодействие со щелочными и щёлочноземельными металлами Водород взаимодействует с активными металлами, образуя
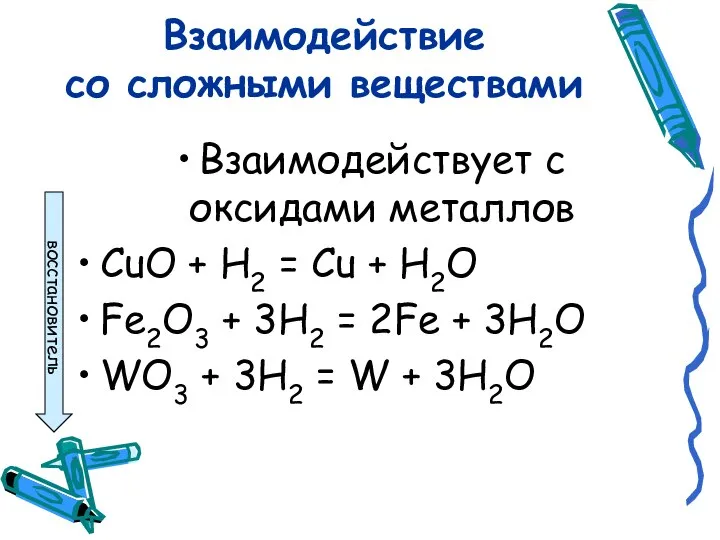
- 7. Взаимодействие со сложными веществами Взаимодействует с оксидами металлов CuO + H2 = Cu + H2O Fe2O3
- 8. Применение водорода Синтез аммиака NH3; Синтез хлороводорода; Синтез метилового и других спиртов; Получение маргарина; Получение молибдена,
- 9. ПРОВЕРЬ СЕБЯ 1. Водород проявляет степень окисления в соединениях: А) +1 и -1; Б) +2 и
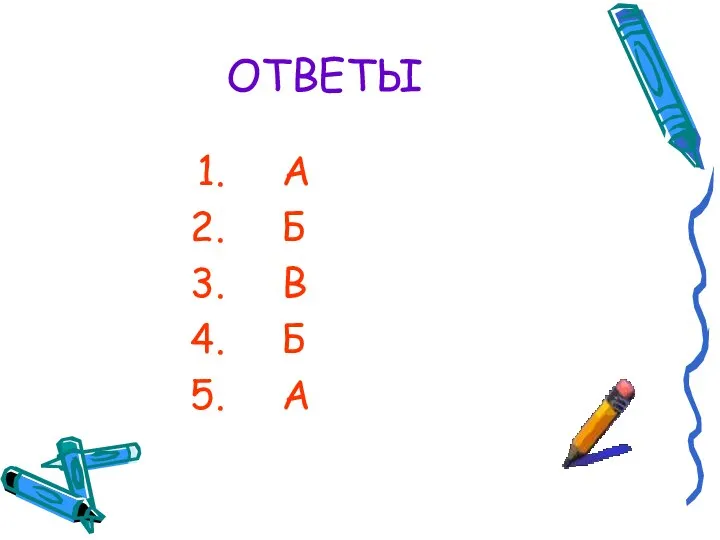
- 10. ОТВЕТЫ А Б В Б А
- 11. ИТОГИ Если ты ответил правильно на все вопросы – получи отметку «5» Если все же ты
- 13. Скачать презентацию






 Ароматические углеводороды
Ароматические углеводороды Презентация на тему Нефть и способы ее переработки
Презентация на тему Нефть и способы ее переработки  Изготовление искусственного янтаря
Изготовление искусственного янтаря Простые и сложные вещества
Простые и сложные вещества Теория химического строения (ТХС). Предпосылки создания
Теория химического строения (ТХС). Предпосылки создания Химический элемент кислород
Химический элемент кислород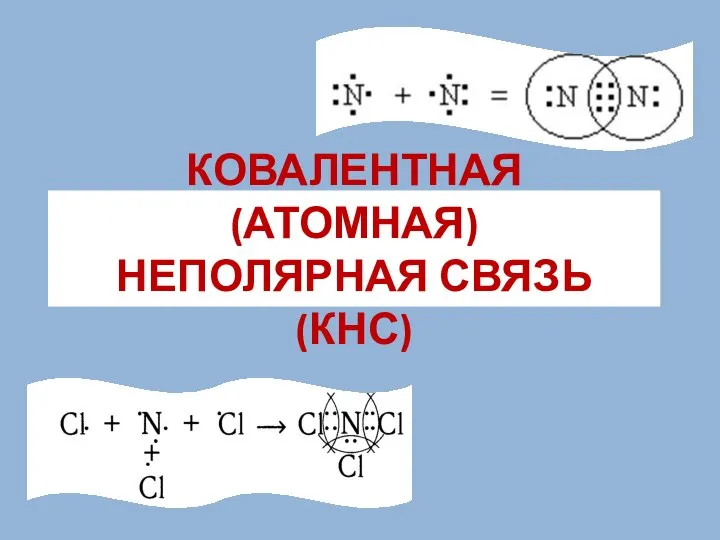 676a1c5e85f2455c9a6d495b8a94b9f9
676a1c5e85f2455c9a6d495b8a94b9f9 Периодический закон и периодическая система химических элементов Д. И. Менделеева. Строение атома
Периодический закон и периодическая система химических элементов Д. И. Менделеева. Строение атома Комментарии к выполненным заданиям по темам Алканы и Алкены. 9 класс
Комментарии к выполненным заданиям по темам Алканы и Алкены. 9 класс Задача №2 Спящий Амур. Команда гимназии №1 Берлинская лазурь
Задача №2 Спящий Амур. Команда гимназии №1 Берлинская лазурь Химия. 8 класс. Подготовка к контрольной работе
Химия. 8 класс. Подготовка к контрольной работе Вычисление массовой доли химического элемента в веществе
Вычисление массовой доли химического элемента в веществе Ароматические соединения. Галогенпроизводные
Ароматические соединения. Галогенпроизводные Подготовка к контрольной работе по теме «Изменения, происходящие с веществами
Подготовка к контрольной работе по теме «Изменения, происходящие с веществами Две стороны личности: композитор и ученый-химик
Две стороны личности: композитор и ученый-химик Экстракция молибдена из азотнокислых растворов карбамоилметилфосфиноксидом, растворенным в высших спиртах
Экстракция молибдена из азотнокислых растворов карбамоилметилфосфиноксидом, растворенным в высших спиртах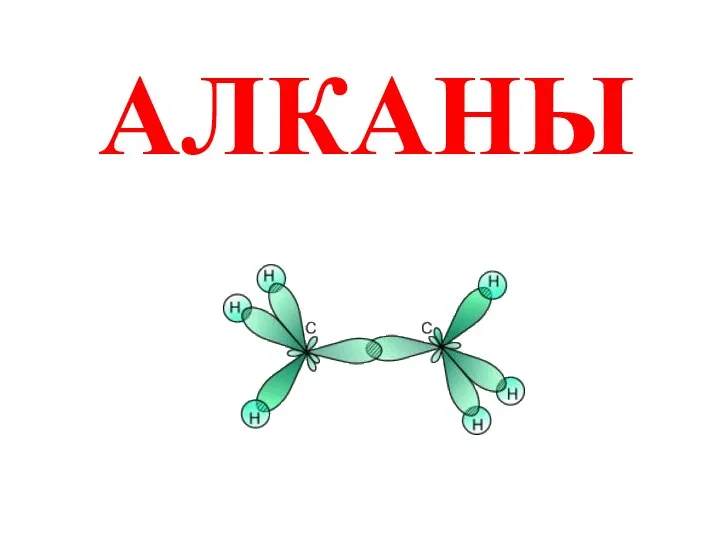 Алканы
Алканы Коалесцирующие фильтры. Моделирование процесса разделения отходов углеводородов коалесцирующими фильтрами
Коалесцирующие фильтры. Моделирование процесса разделения отходов углеводородов коалесцирующими фильтрами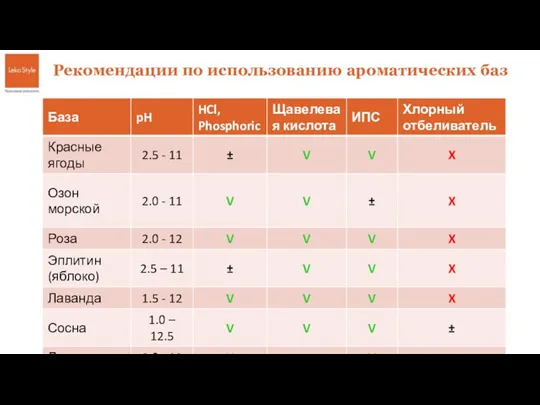 Базы для кислых и щелочных сред
Базы для кислых и щелочных сред Основной государственный экзамен. Химия 2022. Задание 2
Основной государственный экзамен. Химия 2022. Задание 2 Пероксид водорода
Пероксид водорода АТФ и другие органические соединения клетки
АТФ и другие органические соединения клетки Степень окисления веществ
Степень окисления веществ Химическая термодинамика. Термодинамические потенциалы
Химическая термодинамика. Термодинамические потенциалы Elektroliz_Gidroliz
Elektroliz_Gidroliz Кислоты. Кислоты в животном мире
Кислоты. Кислоты в животном мире Липиды. Омыляемые липиды. Рубежный контроль №2
Липиды. Омыляемые липиды. Рубежный контроль №2 Радиоакивные металлы
Радиоакивные металлы