Содержание
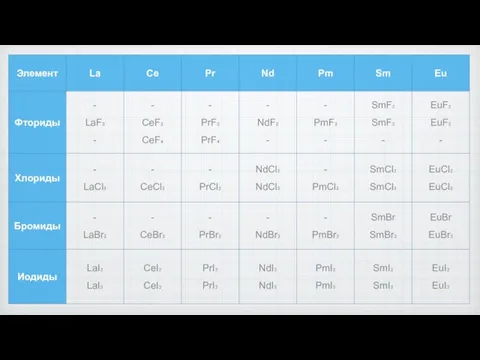
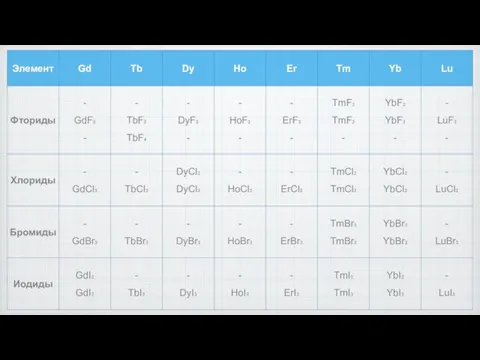
- 2. Галогениды В водных растворах могут образовывать устойчивые комплексы. Устойчивость галогенидов, температуры кипения и плавления уменьшается от
- 5. Фториды Трифториды лантаноидов: устойчивы на воздухе тугоплавкие наименее растворимы в воде и кислотах (растворимость 10-6 -
- 6. Фториды Трифториды Sm, Eu, Yb и Tm могут быть восстановлены до двухвалентного состояния водородом, соответствующим РЗЭ,
- 7. Фториды Получают трифториды саждением солей лантаноидов плавиковой кислотой: Трифториды можно растворить концентрированной серной кислотой при нагревании,
- 8. Фториды 4 PrF + XeF₄ = 4 PrF₄ + Xe TbO₂ + 4 HF = TbF₄
- 9. Фториды Достаточно легко разлагаются на трифториды: 2 СeF₄ + H₂ = 2 CeF₃ + 2 HF
- 10. Хлориды Трихлориды термодинамически менее устойчивы. Растворимы в воде, очень гигроскопичны. Образуют кристаллогидраты. Получают действием соляной кислоты
- 11. Хлориды La₂O₃ + 6 NH₄Cl = 2 LaCl₃ + 6 NH₃ + 3 H₂O (нагревание) LaCl₃
- 12. Хлориды Дихлориды лантаноидов получают взаимодействием трихлорида с восстановителями: 2 SmCl₃ + H₂ = 2 SmCl₂ +
- 13. Бромиды
- 14. Иодиды Растворимы в воде, гигроскопичны, но трииодид европия и прометия были получение чуть позже из-за их
- 15. Иодиды Восстанавливаются до дибромидов: 2 YbI₃ + H₂ = 2 YbI₂ + 2 HI 2 SmI₃
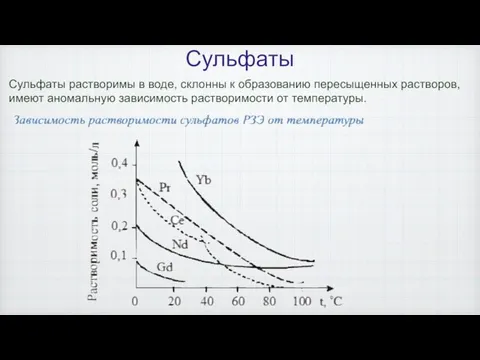
- 16. Сульфаты Сульфаты растворимы в воде, склонны к образованию пересыщенных растворов, имеют аномальную зависимость растворимости от температуры.
- 17. Сульфаты Получают действием разбавленной серной кислоты на металличесткий лантаноид, соли, оксиды и гидроксиды: 2 La +
- 18. Сульфаты Ce(OH)₄ + 2 H₂SO₄ конц = Ce(SO₄)₂ + 4 H₂O CeO₂ + 2 H₂SO₄ конц
- 19. Сульфаты 2 La₂(SO₄)₃ + 2 H₂O пар = 4 La(OH)SO₄ + 2 SO₂ + O₂ (
- 20. Нитраты Хорошо растворимы в воде, гигроскопичны, образуют кристаллогидраты с 4, 5 и 6 молекулами воды. Кристаллогидрат
- 21. Нитраты Химические свойства: 4 Ce(NO₃)₃ = 2 Ce₂O₃ + 12 NO₂ + 3 O₂ ( 800
- 23. Скачать презентацию

















 Металлы
Металлы Предельные одноатомные спирты
Предельные одноатомные спирты Ocena zawartości mikotoksyn w wybranych produktach spożywczych
Ocena zawartości mikotoksyn w wybranych produktach spożywczych анлекция 3
анлекция 3 10 класс Алкадиены более совершенная (2)
10 класс Алкадиены более совершенная (2) Шаблон презентации по химии
Шаблон презентации по химии Относительный вклад % буферных систем крови в поддержание в ней протолитического гомеостаза
Относительный вклад % буферных систем крови в поддержание в ней протолитического гомеостаза Ионные уравнения
Ионные уравнения Расчет равновесного состояния системы натрий-кислород-водород, для энергетических ядерных реакторов
Расчет равновесного состояния системы натрий-кислород-водород, для энергетических ядерных реакторов Химическое кафе «Кислоты»
Химическое кафе «Кислоты» Рубидий (лат. Rubidium)
Рубидий (лат. Rubidium) Алкины
Алкины Алкадиены
Алкадиены Акцепторы катионов и анионов. Хиральные краунэфиры. Гетерокрауны, гетерокриптанды, циклофаны
Акцепторы катионов и анионов. Хиральные краунэфиры. Гетерокрауны, гетерокриптанды, циклофаны Презентация по Химии "Введение в органическую химию в тезисах, аргументах и фактах"
Презентация по Химии "Введение в органическую химию в тезисах, аргументах и фактах"  Номенклатура и изомерия аренов
Номенклатура и изомерия аренов Разминка для болельщиков
Разминка для болельщиков Решение задач. Подготовка к контрольной работе по химии
Решение задач. Подготовка к контрольной работе по химии Основные виды сырья для промышленности органического и нефтехимического синтеза
Основные виды сырья для промышленности органического и нефтехимического синтеза Применение ЦОР на уроках биологии и химии
Применение ЦОР на уроках биологии и химии Сера в таблице Д.И. Менделеева
Сера в таблице Д.И. Менделеева Химия и жизнь
Химия и жизнь ВКР: Определение показателей качества мясной и колбасной продукции различных производителей
ВКР: Определение показателей качества мясной и колбасной продукции различных производителей Массовая доля элемента в веществе
Массовая доля элемента в веществе Гидролиз солей
Гидролиз солей Роль нитрадов. Взгляд специалистов
Роль нитрадов. Взгляд специалистов Материаловедение. Легированные стали и сплавы. (Тема 11)
Материаловедение. Легированные стали и сплавы. (Тема 11)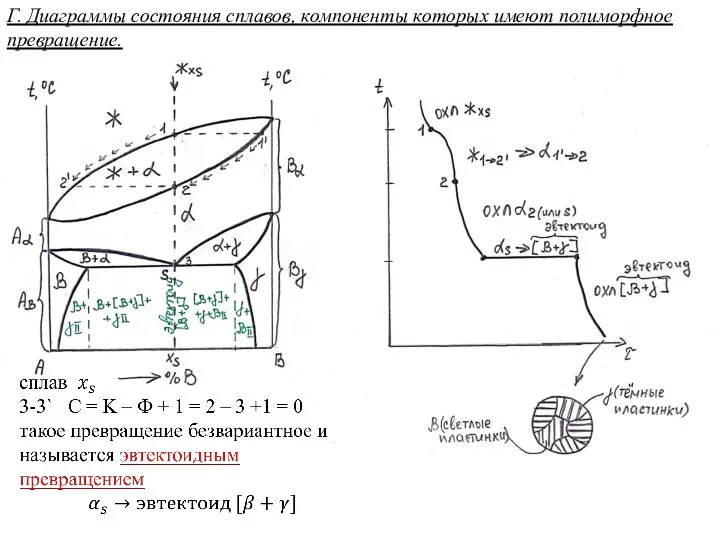 Диаграммы состояния сплавов, компоненты которых имеют полиморфное превращение
Диаграммы состояния сплавов, компоненты которых имеют полиморфное превращение