Слайд 2Расставьте степени окисления
Проверьте, чтобы в реакции были и окислитель, и восстановитель
Не

забываем учитывать индексы в формулах, так как они указывают число атомов данного вида в уравнении. Самая частая проблема — с дихроматом калия K2Cr2O7, когда он в роли окислителя переходит в +3.
Определите, в какой среде (кислой, нейтральной или щелочной) протекает реакция.
Помните, что вода — может как участвовать в реакции, так и образовываться
Иногда какой-либо продукт реакции можно определить, только составив электронный баланс и поняв, каких частиц у нас больше
Слайд 37. Во что переходят реагенты в реакции?
Если ответ на этот вопрос не

дают выученные нами схемы, то нужно проанализировать, какие в реакции окислитель и восстановитель — сильные или не очень?
Если окислитель средней силы, вряд ли он может окислить, например, серу из −2 в +6, обычно окисление идёт только до S0.
Если оба вещества могут проявлять свойства и восстановителя, и окислителя — надо продумать, какое из них более активный окислитель. Тогда второй будет восстановителем.
Если же один из реагентов — типичный окислитель или восстановитель — тогда второй будет «выполнять его волю», либо отдавая электроны окислителю, либо принимая у восстановителя.
Слайд 48. Соблюдайте последовательность расстановки коэффициентов в уравнении:
Сначала проставьте коэффициенты, полученные из

электронного баланса. Помните, что удваивать или сокращать их можно только вместе.
Предпоследним уравнивается водород, а по кислороду мы только проверяем!
Слайд 5Возможные ошибки:
В расстановке С.О.
Выбор продуктов без учёта переноса электронов. Не может быть

окислитель без восстановителя и наоборот.
Неверные с химической точки зрения продукты: не может получиться такое вещество, которое вступает во взаимодействие со средой.
а) в кислой среде не может получиться оксид металла, основание, аммиак;
б) в щелочной среде не получится кислота или кислотный оксид;
в) оксид или тем более металл, бурно реагирующие с водой, не образуются в водном растворе.
Слайд 6ГЛАВНЫЕ СХЕМЫ
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ ПЕРЕХОДОВ

Слайд 7ГЛАВНЫЕ СХЕМЫ
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ ПЕРЕХОДОВ

Слайд 8ГЛАВНЫЕ СХЕМЫ
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ ПЕРЕХОДОВ
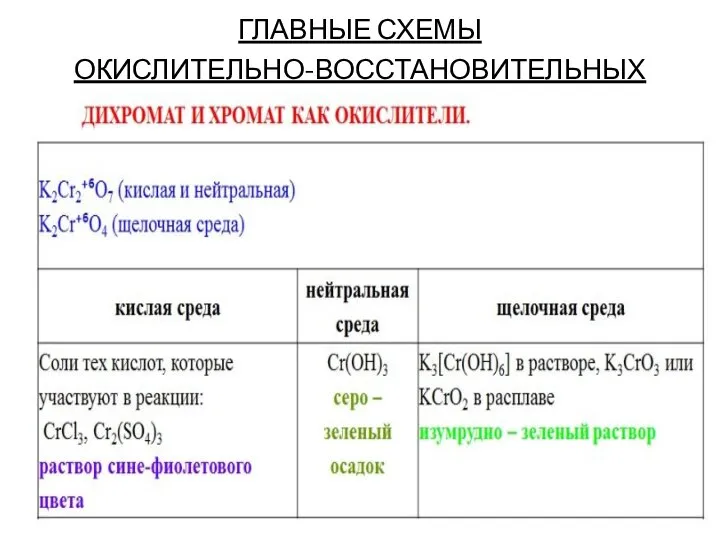
Слайд 9ГЛАВНЫЕ СХЕМЫ
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ ПЕРЕХОДОВ

Слайд 10ГЛАВНЫЕ СХЕМЫ
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ ПЕРЕХОДОВ

Слайд 11ГЛАВНЫЕ СХЕМЫ
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ ПЕРЕХОДОВ
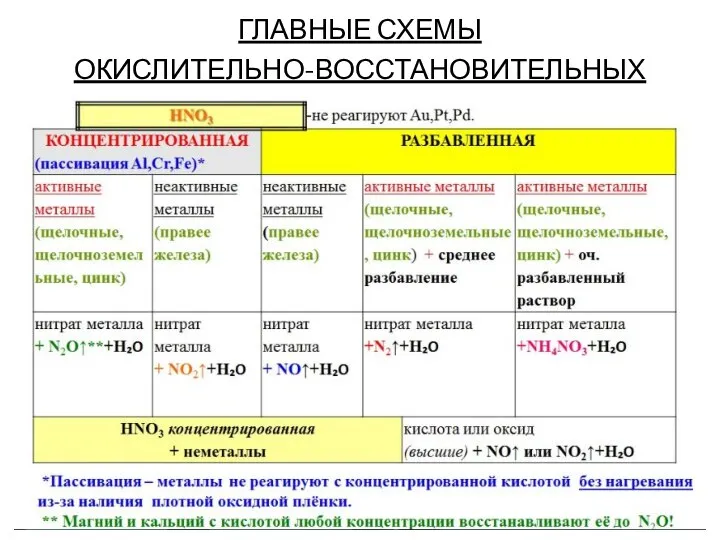
Слайд 12ГЛАВНЫЕ СХЕМЫ
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ ПЕРЕХОДОВ
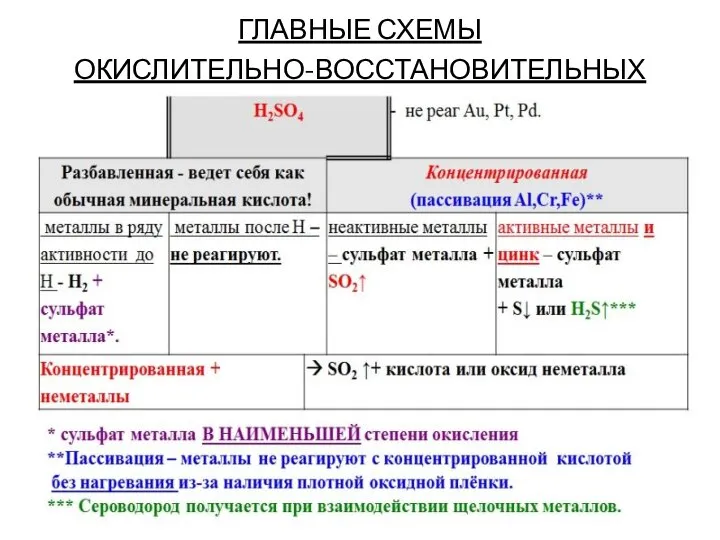
Слайд 13ГЛАВНЫЕ СХЕМЫ
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ ПЕРЕХОДОВ

Слайд 14ГЛАВНЫЕ СХЕМЫ
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ ПЕРЕХОДОВ

Слайд 15ГЛАВНЫЕ СХЕМЫ
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ ПЕРЕХОДОВ

Слайд 16Задание 30 № 7708
Для выполнения задания используйте следующий перечень веществ:
нитрат бария,
нитрат калия,

хлорид калия,
сульфат калия,
магний.
Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Слайд 17Задание 30 № 7708
Для выполнения задания используйте следующий перечень веществ:
марганцовая кислота,
оксид серы (IV),

сульфат бария,
хлорид калия,
нитрат серебра (I)
Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Слайд 18Задание 30 № 7708
Для выполнения задания используйте следующий перечень веществ:
гидросульфид кальция,
азотная кислота,

нитрат натрия,
нитрат бария,
серная кислота
Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.

















 Гидролиз – это обменное взаимодействие веществ с водой, приводящее к их разложению
Гидролиз – это обменное взаимодействие веществ с водой, приводящее к их разложению Особенности формирования естественно-научной картины мира на уроках географии и химии
Особенности формирования естественно-научной картины мира на уроках географии и химии Электрический ток в металлах
Электрический ток в металлах Презентация на тему Хлор
Презентация на тему Хлор  Бутан как хладагент
Бутан как хладагент Хімічна промисловість
Хімічна промисловість Металлы. Общая характеристика, химические свойства. Получение
Металлы. Общая характеристика, химические свойства. Получение Сигнальные молекулы
Сигнальные молекулы Презентация на тему Классификация химических реакций 11 класс
Презентация на тему Классификация химических реакций 11 класс  Хроматография
Хроматография Самородные минералы
Самородные минералы Общие сведения о питании и приготовлении пищи
Общие сведения о питании и приготовлении пищи Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Соли, их классификация и свойства
Соли, их классификация и свойства Простые и сложные вещества
Простые и сложные вещества Пластификация пластмасс
Пластификация пластмасс Основания. 8 класс
Основания. 8 класс Молочная кислота
Молочная кислота Решение задач
Решение задач Презентация на тему Щелочные металлы
Презентация на тему Щелочные металлы  Алкины. Понятие об алкинах
Алкины. Понятие об алкинах Общая химическая технология. Составление материального баланса технологического процесса. Практическое занятие 6
Общая химическая технология. Составление материального баланса технологического процесса. Практическое занятие 6 Серная кислота. Свойства серной кислоты
Серная кислота. Свойства серной кислоты Металлы
Металлы Основы химической кинетики
Основы химической кинетики Химия вокруг нас
Химия вокруг нас Общая характеристика металлов
Общая характеристика металлов Межкристаллитная коррозия МКК
Межкристаллитная коррозия МКК