Содержание
- 2. При рассмотрении межатомных связей вводят: первый потенциал ионизации и сродство атома к электрону. Первый потенциал ионизации
- 3. Если атомы находятся далеко друг от друга, то они ведут себя как свободные. Энергия такой системы
- 4. Пусть мы имеем две частицы одна, из которых расположена в начале координат, а вторая расположена в
- 5. Для того чтобы силы отталкивания при малых расстояниях между частицами превышали силу притяжения, необходимо чтобы n>m
- 6. Чтобы функция U(r) имела минимум, необходимо, чтобы показатель степени потенциала отталкивания был больше показателя степени потенциала
- 7. Водородная связь является частным случаем межмолекулярных связей. Это диполь-дипольная связь двух постоянных диполей. Постоянный диполь создает
- 8. Ван-дер-ваальсова связь также является диполь-дипольной, как и водородная, но, в отличие от последней – это взаимодействие
- 9. Энергия связи в молекулярных кристаллах довольно мала ~0,1 эВ на один атом. В ионных и ковалентных
- 10. Металлическая связь. У атомов первых групп периодической системы элементов (левая часть таблицы) на последней оболочке заполнено
- 11. Таким образом, для появления металлической связи нужно, чтобы в атоме присутствовали слабо связанные электроны. Выигрыш в
- 13. Скачать презентацию
Слайд 2При рассмотрении межатомных связей вводят: первый потенциал ионизации и сродство атома к
При рассмотрении межатомных связей вводят: первый потенциал ионизации и сродство атома к

Энергию Э, освобождающуюся при присоединении электрона к нейтральному невозбужденному атому с образованием аниона, называют сродством атома к электрону. Наибольшим сродством к электрону обладают атомы галогенов (F, Cl, Br, I).
При взаимодействии атомов одного вида с атомами другого вида характер химической связи определяется их способностью захватывать или отдавать валентные электроны - электроотрицательностью атомов Х.
Все элементы периодической таблицы можно расположить в ряд по значению электроотрицательности. Каждый ряд начинается с наиболее электроположительных элементов, склонных к образованию положительных ионов (щелочные металлы). На противоположном конце располагаются наиболее электроотрицательные элементы (галогены). В левой части каждого ряда располагаются металлы, а в правой – элементы с неметаллическими свойствами.
Слайд 3Если атомы находятся далеко друг от друга, то они ведут себя как
Если атомы находятся далеко друг от друга, то они ведут себя как

Слайд 4Пусть мы имеем две частицы одна, из которых расположена в начале координат,
Пусть мы имеем две частицы одна, из которых расположена в начале координат,

Сила притяжения обычно описывается следующей формулой:
где b и m - постоянные целые числа и зависят от природы решетки.
По мере сближения частиц при малых r резко возрастает сила отталкивания.
Обычно полагают
где a и n целые постоянные числа, зависящие от типа решетки.
Слайд 5Для того чтобы силы отталкивания при малых расстояниях между частицами превышали силу
Для того чтобы силы отталкивания при малых расстояниях между частицами превышали силу

Тогда суммарную силу взаимодействия можно представить в виде:
Зная, что
можно показать, что суммарная потенциальная энергия взаимодействия системы 2-х частиц U определяется формулой:
где
Слайд 6Чтобы функция U(r) имела минимум, необходимо, чтобы показатель степени потенциала отталкивания был больше
Чтобы функция U(r) имела минимум, необходимо, чтобы показатель степени потенциала отталкивания был больше

найдем равновесное состояние между атомами :
следует, что энергетическое сцепление в основном определяется потенциалом сил притяжения.
Таким образом, величина энергии связи определяется:
· притяжением атомов, обусловленным взаимодействием валентных электронов;
· кулоновским отталкиванием внутренних оболочек и ядер.
Слайд 7Водородная связь является частным случаем межмолекулярных связей. Это диполь-дипольная связь двух постоянных
Водородная связь является частным случаем межмолекулярных связей. Это диполь-дипольная связь двух постоянных
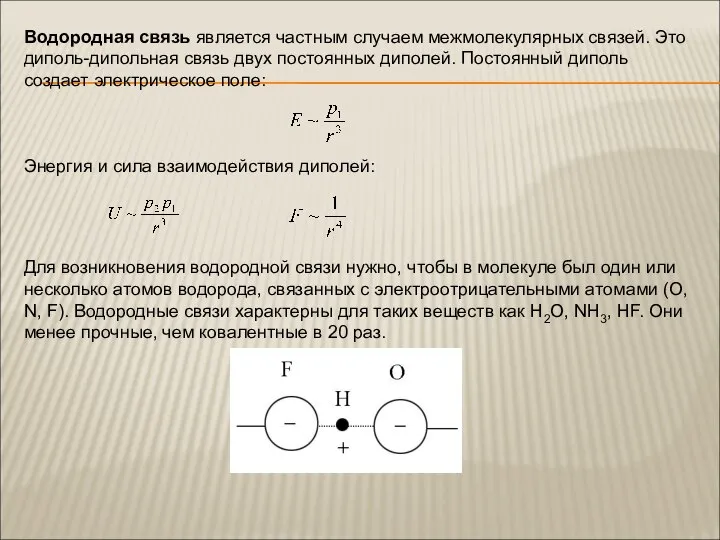
Для возникновения водородной связи нужно, чтобы в молекуле был один или несколько атомов водорода, связанных с электроотрицательными атомами (O, N, F). Водородные связи характерны для таких веществ как H2O, NH3, HF. Они менее прочные, чем ковалентные в 20 раз.
Энергия и сила взаимодействия диполей:
Слайд 8Ван-дер-ваальсова связь также является диполь-дипольной, как и водородная, но, в отличие от
Ван-дер-ваальсова связь также является диполь-дипольной, как и водородная, но, в отличие от

У атома имеется флуктуирующий дипольный момент, определяемый положением электронов на орбитах, он создает поле:
которое поляризует соседний атом, в результате у него наводится дипольный момент
- диэлектрическая восприимчивость
Энергия взаимодействия диполей и сила:
Слайд 9Энергия связи в молекулярных кристаллах довольно мала ~0,1 эВ на один атом.
Энергия связи в молекулярных кристаллах довольно мала ~0,1 эВ на один атом.

Ковалентная связь образуется за счет перекрытия электронных облаков, в результате между атомами образуется сгусток отрицательного заряда, который стягивает два атома. Атом в зависимости от его валентности может иметь несколько таких связей, расположенных под определенными углами друг к другу. Атомы в ковалентном кристалле соединяются за счет ковалентных связей, причем углы между связями и их "длины" могут слегка отличаться для кристаллов с разной структурой. Типичным ковалентным кристаллом можно считать алмаз. В его решетке каждый атом окружен четырьмя соседями, расположенными симметрично по углам тетраэдра относительно него. Именно так часто располагаются ковалентные связи атома углерода. Кристаллы с ковалентной связью обладают высокой твердостью и малой электропроводностью при низких температурах.
Слайд 10Металлическая связь. У атомов первых групп периодической системы элементов (левая часть таблицы)
Металлическая связь. У атомов первых групп периодической системы элементов (левая часть таблицы)

Слайд 11Таким образом, для появления металлической связи нужно, чтобы в атоме присутствовали слабо
Таким образом, для появления металлической связи нужно, чтобы в атоме присутствовали слабо

 Материаловедение. Строение металлических материалов. Металлические сплавы
Материаловедение. Строение металлических материалов. Металлические сплавы Кислородные соединения углерода
Кислородные соединения углерода Знаки химических элементов. Периодическая система
Знаки химических элементов. Периодическая система Арены. Химические свойства
Арены. Химические свойства Номенклатура и изомерия алкенов
Номенклатура и изомерия алкенов Подготовка к экзамену. Органическая химия
Подготовка к экзамену. Органическая химия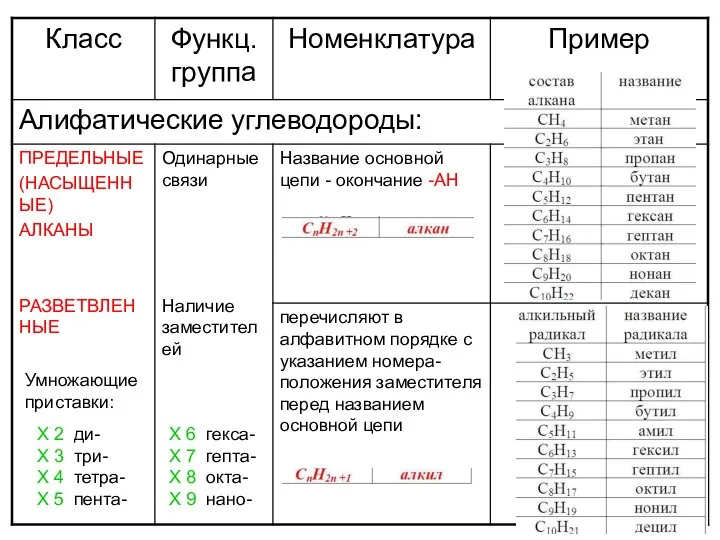 Алифатические углеводороды
Алифатические углеводороды Альдегиды и кетоны. (Лекция 6.2)
Альдегиды и кетоны. (Лекция 6.2) Типы химических реакций. Классификация химических реакций по числу и составу реагентов и продуктов ХР
Типы химических реакций. Классификация химических реакций по числу и составу реагентов и продуктов ХР Нефть - природный источник углеводородов
Нефть - природный источник углеводородов Первые химические символы
Первые химические символы Реакции ионного обмена
Реакции ионного обмена Cтроение жиров
Cтроение жиров Химическая связь. Строение вещества
Химическая связь. Строение вещества Альдегиды
Альдегиды Теория электролитической диссоциации
Теория электролитической диссоциации Ароматические углеводороды на примере бензола
Ароматические углеводороды на примере бензола Положение галогенов в Периодической системе Д.И. Менделеева
Положение галогенов в Периодической системе Д.И. Менделеева Структура периодической таблицы элементов
Структура периодической таблицы элементов Неметаллы – химические элементы
Неметаллы – химические элементы Химическая связь и строение вещества
Химическая связь и строение вещества Плотность вещества
Плотность вещества Производство чугуна и стали
Производство чугуна и стали Презентация на тему Растворы (11 класс)
Презентация на тему Растворы (11 класс)  Substancje chemiczne
Substancje chemiczne Карбоновые кислоты
Карбоновые кислоты Звездный час по химии
Звездный час по химии Металлы. Группы металлов
Металлы. Группы металлов