Содержание
- 2. Основания – это сложные вещества, состоящие из металлов и связанных с ними одного или нескольких гидроксид-ионов.
- 3. Схема образования гидроксида натрия: Н ОН Na гидроксид натрия
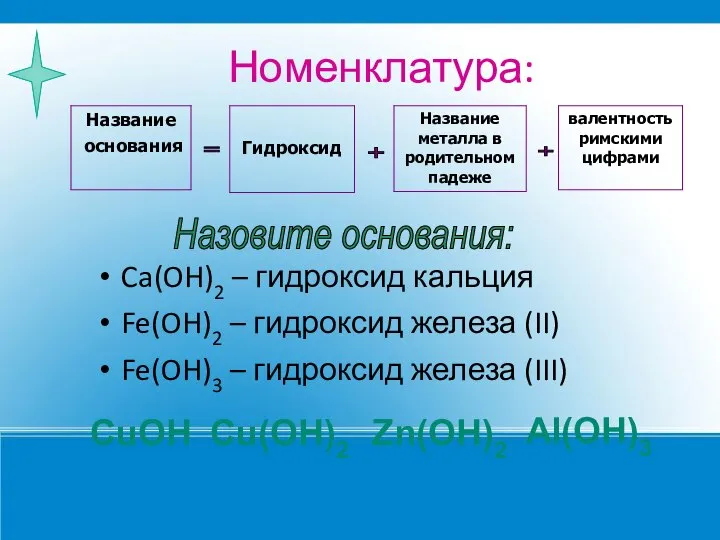
- 4. Номенклатура: Ca(OH)2 – гидроксид кальция Fe(OH)2 – гидроксид железа (II) Fe(OH)3 – гидроксид железа (III) =
- 5. КЛАССИФИКАЦИЯ: NaOH, KOH Cu(OH)2, Fe(OH)2
- 6. Получение 1.Расстворимые в воде основания -щелочи А) активный металл + вода 2Na + 2НOH = 2NaOH
- 7. Физические свойства щелочей Гидроксиды щелочных металлов (едкие щёлочи) представляют собой твердые, белые, очень гигроскопичные вещества. Щёлочи
- 8. Качественные реакции для щелочей малиновый бесцветный Фенолфталеин жёлтый оранжевый Метиловый оранжевый синий фиолетовый Лакмус Щелочная среда
- 9. Химические свойства 1.С кислотами Основание + кислота = Соли + вода NaOH + HCl = NaCl
- 10. 4. С кислотными оксидами Щёлочь + кислотный оксид = соль + вода (р-ция обмена) Ca(OH)2 +
- 12. Скачать презентацию








 Презентация на тему Жесткость воды
Презентация на тему Жесткость воды  Судың химиялық потенциялы
Судың химиялық потенциялы Классификация углеводов
Классификация углеводов Викторина: А не химик ли ты?
Викторина: А не химик ли ты? Оксиды и гидроксиды
Оксиды и гидроксиды Специальные виды перегонки
Специальные виды перегонки Алканы
Алканы Презентация на тему Роль химии в жизни общества
Презентация на тему Роль химии в жизни общества  Степень окисления. Составление химических формул бинарных соединений
Степень окисления. Составление химических формул бинарных соединений Теоретические основы органической химии. Лекция 25
Теоретические основы органической химии. Лекция 25 Характеристика азота как химического элемента и простого вещества
Характеристика азота как химического элемента и простого вещества Метод МО Хюккеля (МОХ)
Метод МО Хюккеля (МОХ) Гидролиз. Виды гидролиза
Гидролиз. Виды гидролиза Химия элементов (лекция 5)
Химия элементов (лекция 5) Классификация нефтей и товарных нефтепродуктов. Основные свойства нефтепродуктов
Классификация нефтей и товарных нефтепродуктов. Основные свойства нефтепродуктов Газ тәрізді өнімдер бромды сутек
Газ тәрізді өнімдер бромды сутек Углерод
Углерод Химия жиров (липидов)
Химия жиров (липидов) Получение серной кислоты
Получение серной кислоты Спирты
Спирты lektsia_7
lektsia_7 Аммиак. Свойства (9 класс)
Аммиак. Свойства (9 класс) Этапы приготовления и микроскопического исследования нативного препарата осадка мочи
Этапы приготовления и микроскопического исследования нативного препарата осадка мочи teoriya_elektroliticheskoy_dissotsiatsii
teoriya_elektroliticheskoy_dissotsiatsii Презентация на тему Основные законы химии
Презентация на тему Основные законы химии  Растворы. Лекция №4
Растворы. Лекция №4 Химические волокна. Урок 1-2
Химические волокна. Урок 1-2 Алканы. Свойства. Строение и применение
Алканы. Свойства. Строение и применение