Слайд 2Наиболее распространенные количественные величины, используемые в химических расчетах:
молярная масса;
количество вещества;
В

Периодической системе химических элементов Д.И. Менделеева приведены средние взвешенные значения молярных масс всех известных химических элементов.
Молярная масса вещества M легко вычисляется по формуле вещества:
Например, Молярная масса M вещества:
сульфата железа (3) ??2(??4)3 будет определяться так:
M[??2(??4)3] = 2М(Fe) + 3М(S) + 3·4М(O).
M[??2(??4)3] = 2 · 56 + 3 · 32 + 12 · 16 = 400г/моль.
Слайд 3
Количество вещества, моль
(обозначается латинской буквой n)
-это реальная физическая величина, показывающая

количество вещества любой химической системы, которая содержит столько же структурных элементов, сколько атомов содержится в (12 г) изотопа углерода С12.
Количество атомов в одном моле атомов изотопа углерода ?12 равно 6,022 · 1023.
Эта величина известна как число Авогадро.
(обозначается ?А).
Слайд 4
Для определения количества вещества любой химической системы можно использовать следующие расчетные формулы:
1)

2) n= NA- число Авогадро, равно 6,022ꞏ 1023
3) данная формула используется только для газов, если условия, при которых находится газ, нормальные (Т0 = 273 К и Р0 = 101325 Па), то молярный
объем равен Vm =22,4 л/моль
Слайд 5 Обучающие примеры с алгоритмами решения по теме:«Основные химические понятия и законы

химии»
Пример1. Определите количество вещества (n) каждого химического соединения, содержащего:
а) 6,02 · 1021 молекул оксида углерода (4) CO2
б) 4,48 л диоксида серы SO2, измеренного при нормальных условиях;
в) 6,8 г аммиака NH3;
M(C)=12г/моль, M(S)=32г/моль, M(O)=16г/моль
M(N)=14г/моль, M(H)=1г/моль,
Слайд 6 дано:
а) N(??2) = 6,02 · 1021
б) V(S?2 ) = 4,48
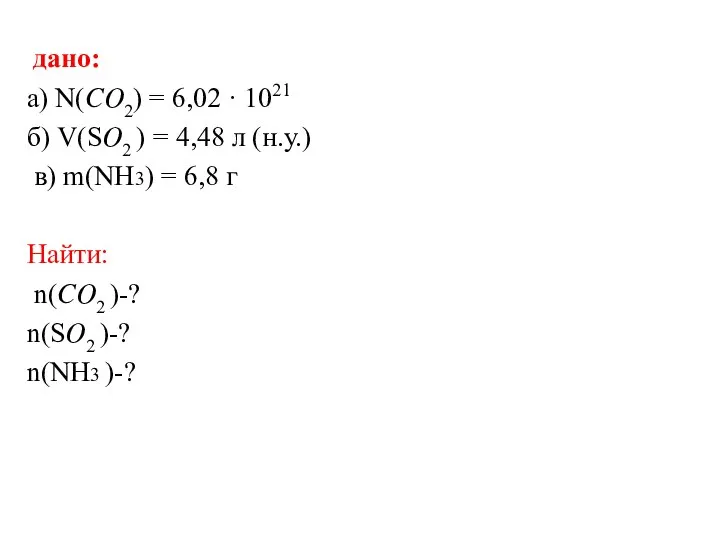
л (н.у.)
в) m(NH3) = 6,8 г
Найти:
n(??2 )-?
n(S?2 )-?
n(NH3 )-?
Слайд 7 Решение:
а) n (??2)= = 6,02 · 1021 / 6,022 · 1023

= 0,01 моль.
б) n (S?2)= = 4,48 / 22,4=0,2 моль
в) n(NH3 )= , M(NH3)=М(N)+3·M(H)
M(NH3 =14+1·3=17г/моль
n(NH3 )= 6,8/ 17=0,4 моль
Слайд 8 Пример 2. Определите количество атомов в 5 г железа (Fe) и

в 3 л гелия (He) (объем измерен при нормальных условиях). M(Fe)=56г/моль,
Дано:
m (Fe) =5г
V(He) =3л
Найти:
N (Fe) -?
N (He) -?
Слайд 9 Решение:
1) n (Fe)=
2) n (He)=

Слайд 10 Решение:
Так как : n=
1) N (Fe)=
2) N (He)=

Слайд 11 Пример 3. Определите, в каком образце содержится больше молекул: в 2

г меди (Cu) или в 2 л кислорода (O2)(объем измерен при нормальных условиях). Ответ обоснуйте соответствующими расчетами. M(Сu)=64г/моль
Дано:
m (Cu) =2г
V(O2) =2л
Найти:
N (Cu) -?
N (O2) -?
Слайд 13 Решение:
Так как : n=
1) N (Cu)=
2) N (O2)=
Ответ: N

(O2) > N (Cu)
Слайд 14 пример4.Рассчитайте число атомов кислорода в 4,9г бертолетовой соли (KClO3).
M(K)=39г/моль, M(Cl)=35,5г/моль,

M(0)=16г/моль
Дано:
m(KClO3)=4,9г
Найти:N(О)=?
Решение: М=39+35,5+3*16=122,5г/моль
n(KClO3)=
n(KClO3)=4,9/122,5=0,04моль
В одной молекуле соли (KClO3) содержится три атома кислорода (индекс кислорода в формуле соли 3), поэтому: n(O)=3·0,04=0,12моль.
Слайд 15
Так как: n= => N=n ·NA
N(O)=n(O)·NA=0,12· 6,022 · 1023 =
= 0,72·
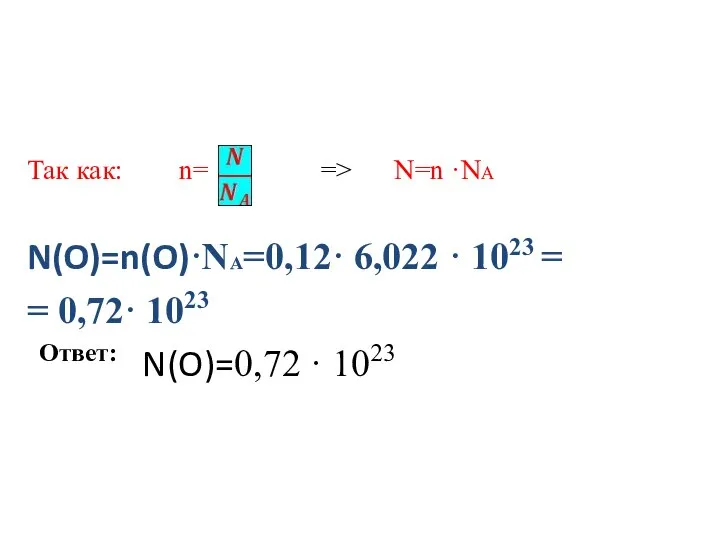
1023
Ответ: N(O)=0,72 · 1023
Слайд 16Пример 5.
Определите число атомов водорода в 17 г аммиака (NH3 ).
M(N)=14г/моль,

M(H)=1г/моль,
Дано:
m(NH3)=17г
Найти:
N(H)-?
Слайд 18 Пример 6.
Определите число атомов кислорода в 12 г углекислого газа (??2).

M(C)=12г/моль, M(O)=16г/моль
Дано:
m(??2)=12г
Найти:
N(O)-?
Слайд 20 пример 7.
Химическое соединение содержит натрий (массовая доля 36,5 %), серу (25,4

%) и кислород (38,1 %). Определите простейшую формулу этого вещества.
M(Na)=23г/моль, M(S)=32г/моль, M(O)=16г/моль
Дано:
ω (Na)=36,5 %
ω(S)=25,4 %
ω(O)=38,1 %
Найти:
NaxSyOz-?
Слайд 21 Решение:
Берем образец вещества массой 100г, тогда
m (Na)=36,5г
m(S)=25,4г
m(O)=38,1г
Определяем количество вещества

каждого элемента:
n (Na)= =36,5/23=1,5869моль
n(S)= =25,4/ 32=0,7937моль
n(O)= =38,1/16=2,3812моль
n (Na) : n(S) : n(O)=1,5869 : 0,7937: 2,3812=2:1:3
Ответ:Na2SO3
Слайд 22Пример 8. В соединении калия, хлора и кислорода массовые доли элементов равны

соответственно: 31,8 %; 29,0 %; 39,2 %. Установите простейшую формулу этого вещества. ). M(K)=39г/моль, M(Cl)=35,5г/моль, M(O)=16г/моль
Дано:
ω (K)=31,8 %
ω(Cl)=29,0 %
ω(O)=39,2 %
Найти:
KxClyOz-?
Слайд 23 Решение:
Берем образец вещества массой 100г, тогда
m (K)=31,8г
m(Cl)= 29,0 г
m(O)=

39,2 г
Определяем количество вещества каждого элемента:
n (K)= =31,8/39=0.8153моль
n(Cl)= =29/ 35,5=0,8169моль
n(O)= =39,2/16=2,45моль
n (K) : n(Cl) : n(O)=0,8153 : 0,8169: 2,45=1:1:3
Ответ:KClO3
Слайд 24 пример 9.
При полном сгорании 11,5 г органического вещества, состоящего из углерода,

водорода и кислорода, образовалось 11,2 л диоксида углерода (объем измерен при н.у.) и 13,5 мл воды. Плотность паров этого вещества по водороду равна 23. Выведите молекулярную формулу органического вещества и напишите уравнение реакции его горения. ). M(C)=12г/моль, M(H)=1г/моль, M(O)=16г/моль
Дано:
m(CxHyOz)=11,5г
V(??2)= 11,2 л
V(H2O)= 13,5мл
DH2(CxHyOz)=23
Найти:CxHyOz
Слайд 25 решение:
n(??2)= V/Vm=11,2:22,4=0,5моль
n(?)=n(??2)=0,5моль
m(H2O)=?(?2?) · ?(?2?)=1 · 13,5=13,5г
?(?2?)=m/M=13,5:18=0,75моль
n(H) =2 · 0,75=1,5моль
Определяем массу кислорода

по формуле:
m(O)=m(CxHyOz)-(m(C)+m(H))
m(?)=n(?) · M(C)=0,5 ·12=6г
m(H) =n(H) · M(H)=1,5·1=1,5г
m(O)=11,5-(6+1,5)=4г
?(?)=m/M=4:16= 0,25 моль
n(?): n(H): ?(?)=0,5 :1,5: 0,25 =2:6:1
Простейшая формула вещества:C2H6O
M(C2H6O)=46 г⁄моль.




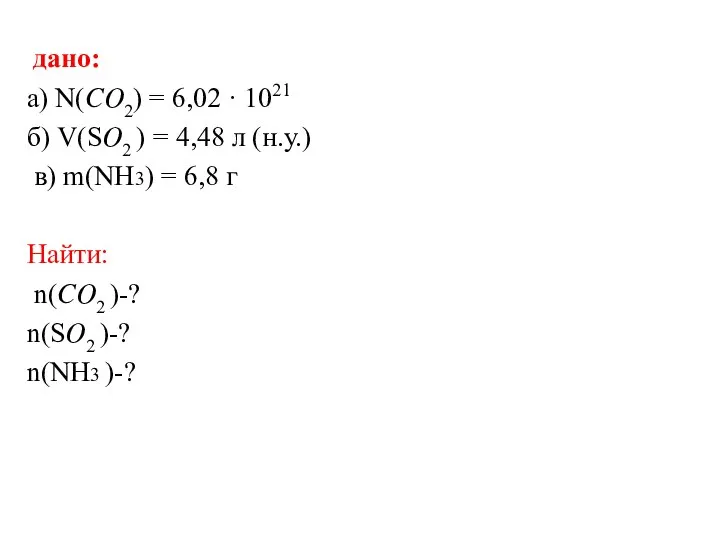





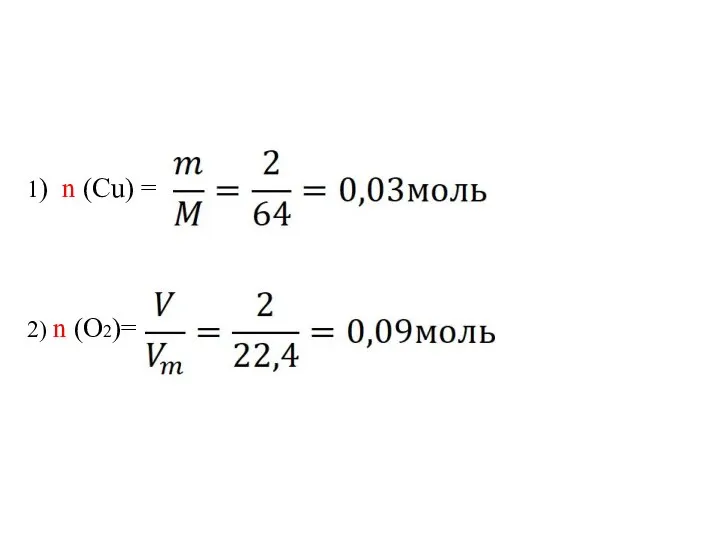


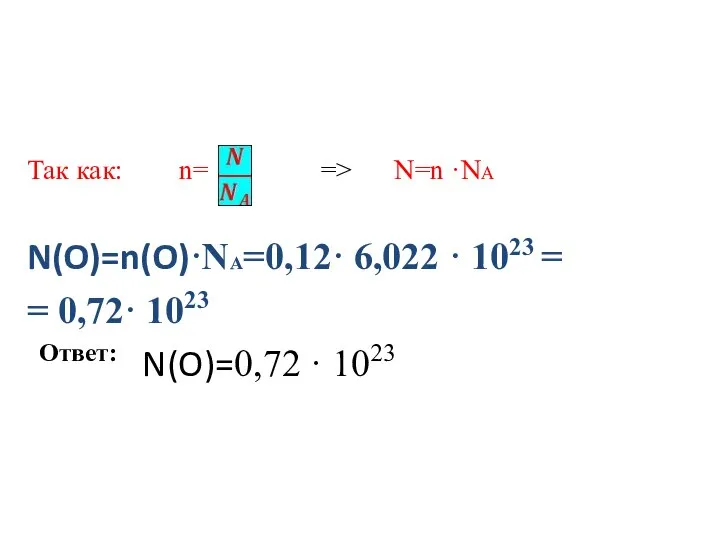

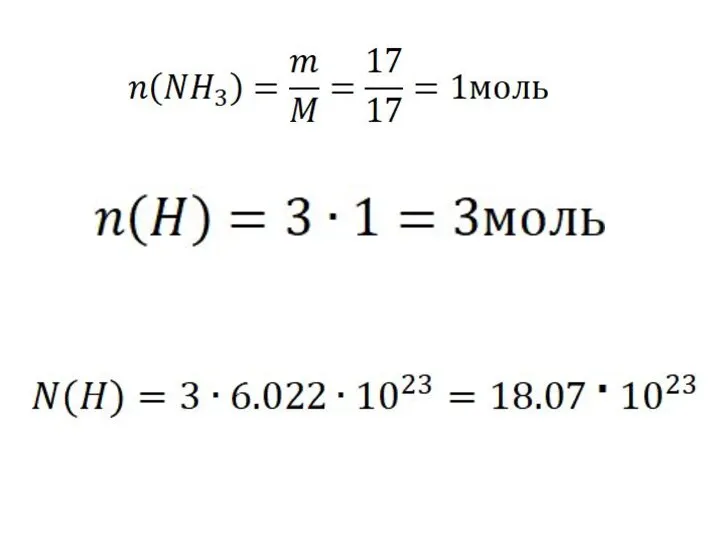








 Соли Na2SO4
Соли Na2SO4 Понятия и законы в химии. (Лекция 1)
Понятия и законы в химии. (Лекция 1) Презентация на тему Жидкое состояние вещества
Презентация на тему Жидкое состояние вещества  Презентация на тему Галогены
Презентация на тему Галогены  Презентация на тему Классы неорганических веществ. Электролитическая диссоциация
Презентация на тему Классы неорганических веществ. Электролитическая диссоциация  Магнитный момент атома. Периодическая система элементов Д.И. Менделеева
Магнитный момент атома. Периодическая система элементов Д.И. Менделеева Презентация на тему pH жидкостей, необходимых для человека
Презентация на тему pH жидкостей, необходимых для человека  Плавленые сыры без фосфатов
Плавленые сыры без фосфатов Prezentatsia1_1 (1)
Prezentatsia1_1 (1) Строение атома
Строение атома Планетарная модель атома и его строение
Планетарная модель атома и его строение Составитель: Денисова В.Г.
Составитель: Денисова В.Г. Кислоты и соли
Кислоты и соли Общие способы получения металлов
Общие способы получения металлов Алкадиены
Алкадиены Триметилалюминий
Триметилалюминий Биотит и тальк
Биотит и тальк Получение формальдегида методом дегидрирования метанола
Получение формальдегида методом дегидрирования метанола Электроны в кристаллах. Квантовая теория свободных электронов в металлах
Электроны в кристаллах. Квантовая теория свободных электронов в металлах Основы материаловедения. Раздел 1
Основы материаловедения. Раздел 1 Строение органических соединений
Строение органических соединений Изучение адсорбции аминокислот на поверхности гидроксилапатита при варьировании рН
Изучение адсорбции аминокислот на поверхности гидроксилапатита при варьировании рН Презентация на тему Экологические риски при добыче и переработке нефти
Презентация на тему Экологические риски при добыче и переработке нефти  Альдегиды и кетоны
Альдегиды и кетоны Алгоритм решения задач по химии.
Алгоритм решения задач по химии. Сера и ее соединения
Сера и ее соединения Белки
Белки Презентация на тему Подгруппа углерода и азота
Презентация на тему Подгруппа углерода и азота