Содержание
- 2. Теоретические вопросы Скорость химической реакции, факторы, влияющие на нее. Уравнение скорости для простых и сложных реакций
- 3. Скорость хим. реакции: изменение количества вещества в единицу времени: V = -dC/dt Факторы, влияющие на скорость:
- 4. Теоретические вопросы Уравнение скорости для реакций первого порядка. Период полупревращения (полураспада). Мономолекулярные реакции. Примеры мономолекулярных реакций.
- 5. Кинетическое уравнение реакции 1-ого порядка: V = -dC/dt = k*CA, т.е. А → ..., А -
- 6. Катализ: инициирование или увеличение скорости реакции под действием катализатора. Катализаторы: изменяют скорость реакции, но в результате
- 7. Задача 1 Газовая реакция 2NO + 2H2 -> N2 + 2H20 подчиняется кинетическому уравнению V=k*C2(NO)*C(H2). Каковы
- 8. Задача 2 Какая из приведённых ниже реакций протекает при обычных условиях быстрее? Укажите примерную величину энергии
- 9. Задача 3 Приведены энергии активации прямой реакции разложения йодистого водорода ( HI ↔ 0,5 H2 +0,5
- 10. Задача 4 Запишите процесс b-распада 1 моль трития. Рассчитайте объем газа (н.у.), который образовался за 2
- 11. Задача 5 Установлено, что разложение некоторого вещества протекает по уравнению первого порядка. Определите значение константы скорости
- 13. Скачать презентацию










 Алюминий и его сплавы, их характеристика. Деформируемые сплавы алюминия. Деформируемые и литейные сплавы алюминия
Алюминий и его сплавы, их характеристика. Деформируемые сплавы алюминия. Деформируемые и литейные сплавы алюминия Презентация на тему Теллур
Презентация на тему Теллур  Вещество как система. Основы классификации и номенклатуры неорганических веществ
Вещество как система. Основы классификации и номенклатуры неорганических веществ Теория электролитической диссоции
Теория электролитической диссоции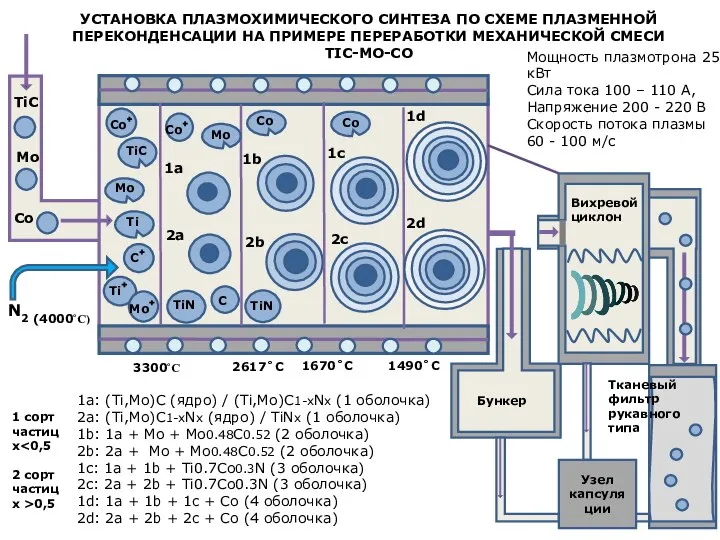 Установка плазмохимического синтеза по схеме плазменной переконденсации на примере переработки механической смеси tic-mo-co
Установка плазмохимического синтеза по схеме плазменной переконденсации на примере переработки механической смеси tic-mo-co Предмет химии. Вещества и их свойства
Предмет химии. Вещества и их свойства Презентация на тему Медь
Презентация на тему Медь  Кислоты. Что нас объединяет?
Кислоты. Что нас объединяет? Фуллерены
Фуллерены AMFOTERNOST__1
AMFOTERNOST__1 Презентация на тему Электронное и пространственное строение молекулы метана
Презентация на тему Электронное и пространственное строение молекулы метана  Основания. Классификация
Основания. Классификация Чистые вещества и смеси
Чистые вещества и смеси Презентация на тему Катализ
Презентация на тему Катализ 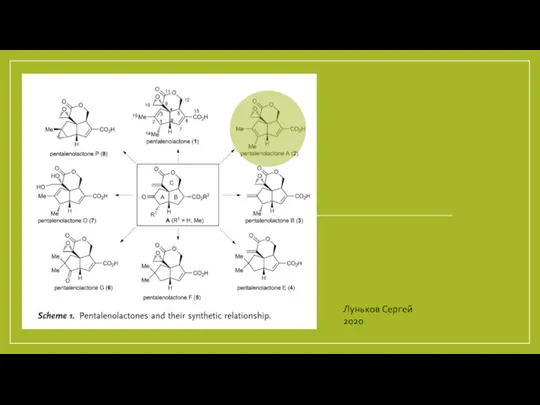 Полный синтез метилового эфира - пенталенолактона
Полный синтез метилового эфира - пенталенолактона Признаки реакции
Признаки реакции Вводный урок по химии
Вводный урок по химии Тесты по химии (вопросы)
Тесты по химии (вопросы) Химические реакции
Химические реакции Horenie
Horenie Путешествие в страну Металлию. Тест по химии
Путешествие в страну Металлию. Тест по химии Электронная структура атомов
Электронная структура атомов ЕГЭ по химии
ЕГЭ по химии Проектная работа Кристаллизация
Проектная работа Кристаллизация Капроновая (гексановая) кислота
Капроновая (гексановая) кислота Презентация на тему Количество вещества. Молярная масса
Презентация на тему Количество вещества. Молярная масса  Калий. В природе
Калий. В природе Металлы. Повторение
Металлы. Повторение