Содержание
- 2. Химическая кинетика – раздел химии, изучающий скорость и механизм химических реакций.
- 3. Системы: Гомогенные (однородные) – системы, в которых не видна поверхность раздела между компонентами. Газовые смеси, растворы.
- 4. Реакции: Гомогенные – реакции, протекающие в гомогенных системах. Протекают во всем объеме системы. Гетерогенные– реакции, протекающие
- 5. Скорость химической реакции - изменение концентрации одного из реагирующих веществ за единицу времени в единице объёма.
- 6. Влияние площади соприкосновения реагирующих веществ на скорость реакции. 1. Скорость гетерогенных реакций зависит от площади соприкосновения
- 7. Молярная концентрация – показывает количество молей вещества, находящееся в 1 литре. С = n / V
- 8. Задание 1. 1.В сосуде объёмом 5 литров находится 1 моль водорода. Рассчитайте молярную концентрацию водорода. 2.
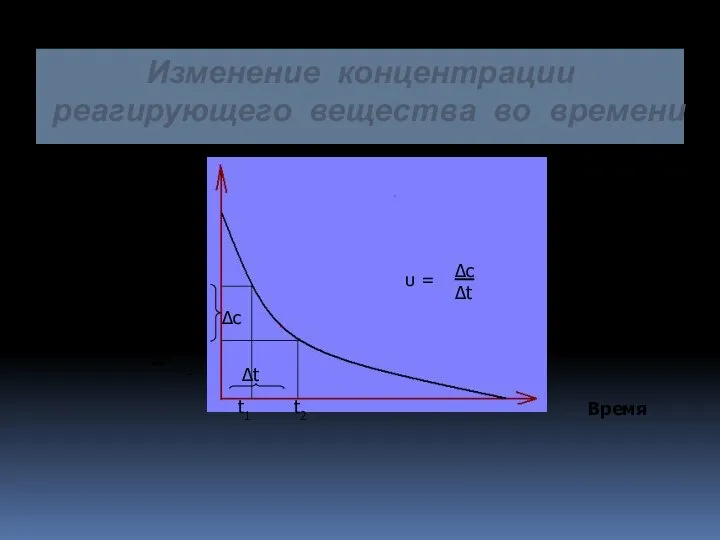
- 9. Изменение концентрации реагирующего вещества во времени С Концентрацця Время С1 С2 t1 t2 ∆c ∆t υ
- 10. Факторы, влияющие на скорость реакции 1. Концентрация реагирующих веществ. 2.Температура. 3. Природа реагирующих веществ. 4. Площадь
- 11. Влияние концентрации реагирующих веществ на скорость реакции. Чем больше концентрация реагирующих веществ, тем чаще сталкиваются частицы
- 12. Закон действия масс: скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степени стехиометрических коэффициентов.
- 13. mА + nB = AmBn υ = k٠САm٠CBn k – константа скорости реакции: k = υ,
- 14. Запишите выражение ЗДМ для реакций: 2СО + О2 = 2СО2 N2 + 3H2 = 2NH3 4P
- 15. Расчетные задачи: 2. Во сколько раз необходимо повысить давление в системе: N2(г) + 3H2(г) → 2NH3(г),
- 16. Температура. Правило Вант-Гоффа: при повышении температуры на каждые 100С скорость большинства реакций увеличивается в 2 –
- 17. Расчетные задачи: Как изменится скорость некоторой реакции при уменьшении температуры 300С до 00С, если температурный коэффициент
- 18. Влияние температуры на скорость реакции. При повышении температуры, увеличивается скорость движения частиц, поэтому они чаще сталкиваются,
- 19. Влияние природы реагирующих веществ на скорость реакции. 2К+2Н2О=2КОН+Н2↑ 2Н2+О2=2Н2О
- 20. Влияние природы реагирующих веществ на скорость реакции. Са+2Н2О=Са(ОН)2+Н2↑
- 21. Влияние природы реагирующих веществ на скорость реакции. Чем активнее вещество, тем скорость реакции с его участием
- 22. Взаимодействие металлов с кислотами Zn + 2HCl = ZnCl2 + H2↑ υ 1 Fe + 2HCl
- 23. Влияние площади соприкосновения реагирующих веществ на скорость реакции. 1. Скорость гетерогенных реакций зависит от площади соприкосновения
- 24. Влияние площади соприкосновения реагирующих веществ на скорость реакции. Чем больше поверхность соприкосновения веществ, тем больше скорость
- 26. Скачать презентацию






















 Обратимые и необратимые химические реакции. Химическое равновесие
Обратимые и необратимые химические реакции. Химическое равновесие Кислоты. Общая формула кислот
Кислоты. Общая формула кислот Натуральный каучук
Натуральный каучук Стекло. Виды стекла
Стекло. Виды стекла Электролиз и его применение
Электролиз и его применение Мемо-химия. Защита проекта
Мемо-химия. Защита проекта Изменения, происходящие с веществами
Изменения, происходящие с веществами Ароматические углеводороды. Арены
Ароматические углеводороды. Арены Исследование возможности создания порохов на основе 1,1диамино-2,2-динитроэтилена
Исследование возможности создания порохов на основе 1,1диамино-2,2-динитроэтилена Значение воды на Земле
Значение воды на Земле Многообразие органических веществ
Многообразие органических веществ Нуклеиновые кислоты
Нуклеиновые кислоты Заполни электронные уровни элементов
Заполни электронные уровни элементов Основы химической термодинамики и термохимии
Основы химической термодинамики и термохимии Уксусная кислота
Уксусная кислота Лекарственные средства – производные пиримидина
Лекарственные средства – производные пиримидина Презентация на тему Химия наука о веществах
Презентация на тему Химия наука о веществах  Карбонильные соединения (альдегиды)
Карбонильные соединения (альдегиды) Относительная молекулярная масса вещества
Относительная молекулярная масса вещества Алкены. Гомологический ряд алкенов. Изомерия алкенов
Алкены. Гомологический ряд алкенов. Изомерия алкенов Дополнительный_материал_11.15_23.09.2022_e4f87550
Дополнительный_материал_11.15_23.09.2022_e4f87550 Качественные реакции в химии
Качественные реакции в химии Презентация на тему Основные законы химии
Презентация на тему Основные законы химии  Методика измерений массовой концентрации ионов аммония в природных и сточных водах фотометрическим методом с реактивом Несслера
Методика измерений массовой концентрации ионов аммония в природных и сточных водах фотометрическим методом с реактивом Несслера Химическая связь
Химическая связь Полимеры. Виды полимеров
Полимеры. Виды полимеров Оксиды и гидроксиды
Оксиды и гидроксиды Контроль якості імуногематологічних досліджень за допомогою діагностичних моноклональних реагентів та стандартних еритроцитів
Контроль якості імуногематологічних досліджень за допомогою діагностичних моноклональних реагентів та стандартних еритроцитів