Содержание
- 2. ПРОВЕРЬ СВОИ ЗНАНИЯ Вещества, растворы которых проводят электрический ток, называют ……… Процесс распада электролита на ионы
- 3. ПРОВЕРЬ СВОИ ЗНАНИЯ (дополните схему) ЭЛЕКТРОЛИТЫ (по степени электролитической диссоциации )
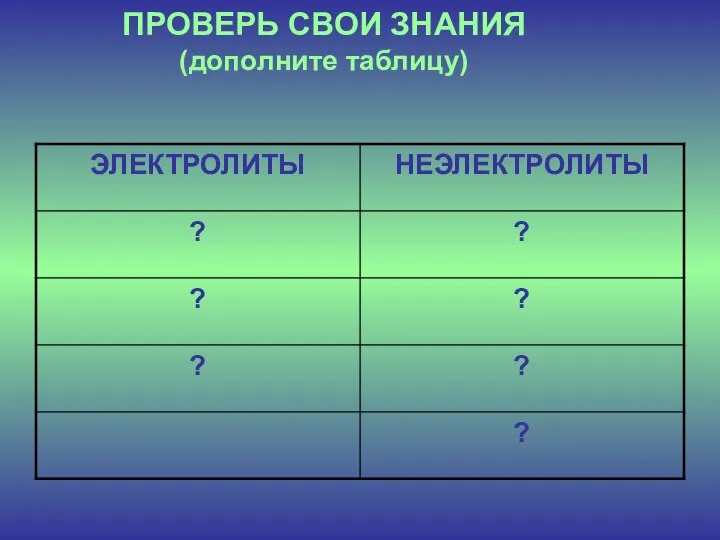
- 4. ПРОВЕРЬ СВОИ ЗНАНИЯ (дополните таблицу)
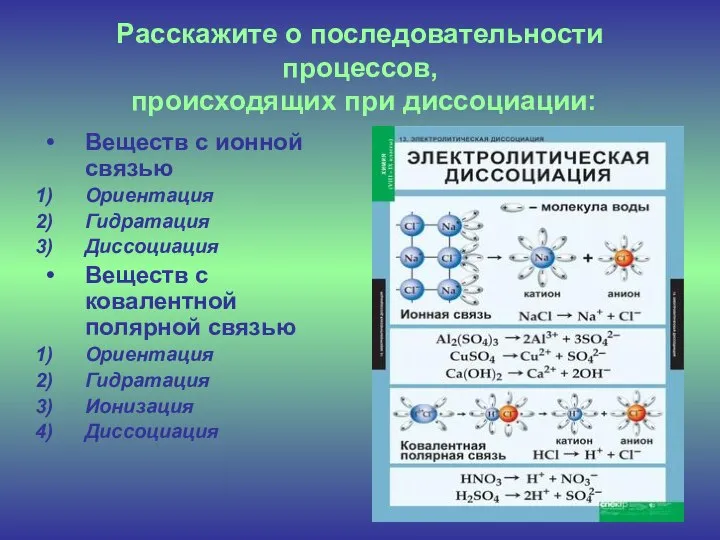
- 5. Расскажите о последовательности процессов, происходящих при диссоциации: Веществ с ионной связью Ориентация Гидратация Диссоциация Веществ с
- 6. История открытия теории электролитической диссоциации В 1887 году шведский химик Сванте Аррениус сформулировал основные положения теории
- 7. Основные положения ТЭД При растворении в воде электролиты диссоциируют (распадаются) на положительные и отрицательные ионы. NaCl
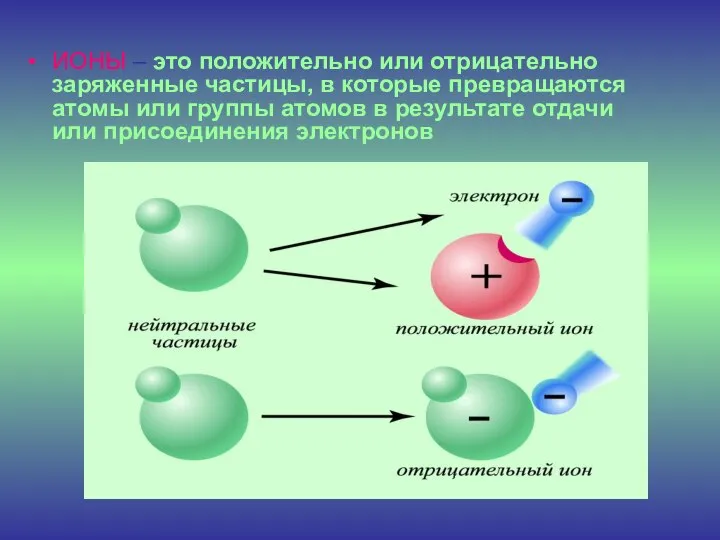
- 8. ИОНЫ – это положительно или отрицательно заряженные частицы, в которые превращаются атомы или группы атомов в
- 9. ЭЛЕКТРОННЫЕ ФОРМУЛЫ +11Na0 2ē 8ē 1ē +11Na+ 2ē 8ē атом ион +17Cl0 2ē 8ē 7ē +17Cl0
- 10. ИОНЫ (по составу) ПРОСТЫЕ Например: Cl- K+ СЛОЖНЫЕ Например: NO3- SO42-
- 11. Основные положения ТЭД 2. Причиной диссоциации электролита в водном растворе является его гидратация, т.е. взаимодействие электролита
- 12. ИОНЫ (по наличию водной оболочки) ГИДРАТИРОВАННЫЕ Например: В растворах и кристаллогидратах CuSO4 * 5H2O Na2SO4* 10H2O
- 13. Основные положения ТЭД 3. Под действием электрического тока положительно заряженные ионы движутся к отрицательному полюсу источника
- 14. ИОНЫ (по знаку заряда) КАТИОНЫ положительно заряженные частицы АНИОН отрицательно заряженные частицы
- 15. Основные положения ТЭД 4. Электролитическая диссоциация – процесс обратимый для слабых электролитов. Наряду с процессом диссоциации
- 16. Основные положения ТЭД 5. Не все электролиты в одинаковой мере диссоциируют на ионы.
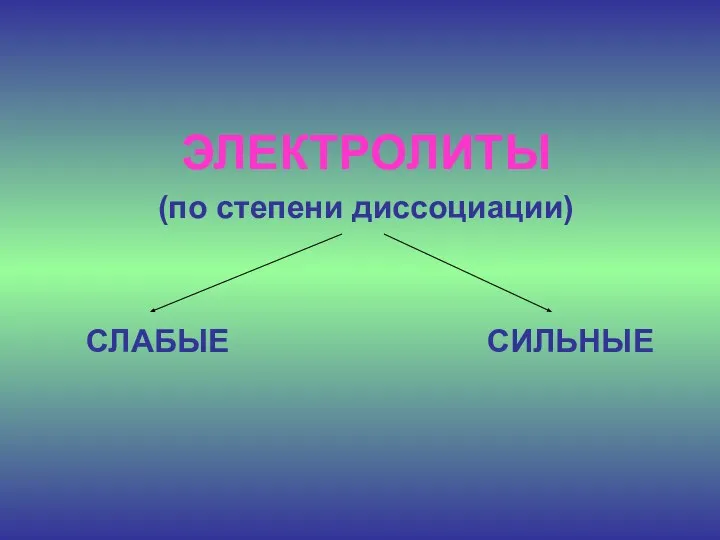
- 17. ЭЛЕКТРОЛИТЫ (по степени диссоциации) СЛАБЫЕ СИЛЬНЫЕ
- 18. Основные положения ТЭД 6. Химические свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при
- 19. ЭЛЕКТРОЛИТЫ (по характеру образующихся ионов) КИСЛОТЫ ОСНОВАНИЯ СОЛИ
- 20. ЗАДАНИЕ Составьте возможные уравнения электролитической диссоциации веществ в водных растворах. 1) HCl 2) HNO3 3) Н2SiO3
- 21. ДОПИШИТЕ ОПРЕДЕЛЕНИЕ Кислоты – это электролиты, которые диссоциируют на катионы и анионы
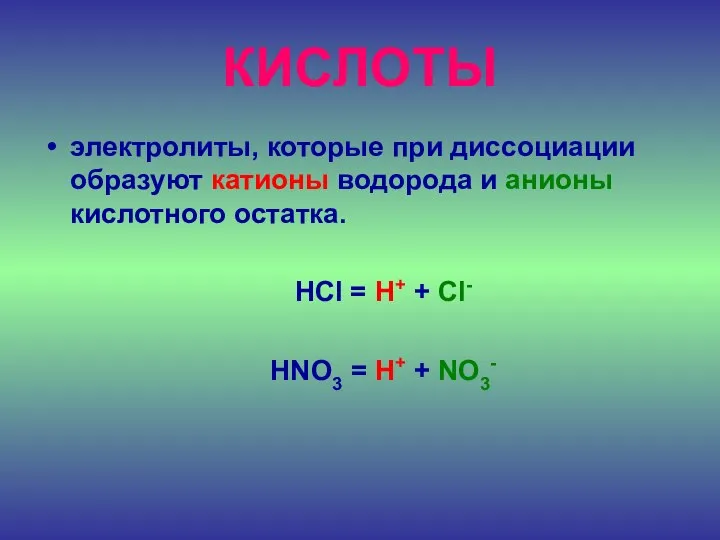
- 22. КИСЛОТЫ электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка. HCl = H+ +
- 23. Многоосновные кислоты диссоциируют ступенчато H3PO4 (фосфорная кислота) 1) Образование дигидрофосфат-ионов H3PO4 ↔ H+ + H2PO4- 2)
- 24. ЗАДАНИЕ Составьте возможные уравнения электролитической диссоциации веществ в водных растворах. 1) NaOH 2) KOH 3) Fe(OH)2
- 25. ДОПИШИТЕ ОПРЕДЕЛЕНИЕ Основания – это электролиты, которые диссоциируют на катионы и анионы
- 26. ОСНОВАНИЯ электролиты, которые при диссоциации образуют катионы металла и гидроксид-анионы. NaOH = Na+ + OH- KOH
- 27. Многокислотные основания диссоциируют ступенчато Ba(OH)2 (гидроксид бария) 1) Образование гидроксо-ионов бария Ba(OH)2 ↔ OH- + BaOH+
- 28. ЗАДАНИЕ Составьте возможные уравнения электролитической диссоциации веществ в водных растворах. 1) NaCl 2) KNO3 3) BaSO4
- 29. ДОПИШИТЕ ОПРЕДЕЛЕНИЕ Cоли – это электролиты, которые диссоциируют на катионы и анионы
- 30. СОЛИ электролиты, которые при диссоциации образуют катионы металла (или аммония NH4) и анионы кислотных остатков. K3PO4
- 32. Скачать презентацию























 Презентация на тему Характеристика щелочных металлов 9 класс
Презентация на тему Характеристика щелочных металлов 9 класс  Химия. Решение задач
Химия. Решение задач Авиационное материаловедение. Лекция №1: Введение. Теория сплавов
Авиационное материаловедение. Лекция №1: Введение. Теория сплавов Презентация на тему Бром
Презентация на тему Бром  Презентация на тему Кремний и его соединения
Презентация на тему Кремний и его соединения  Природный газ. Алканы
Природный газ. Алканы Презентация на тему История семи великих камней Алмазного фонда России
Презентация на тему История семи великих камней Алмазного фонда России  Типы реакций в неорганической химии. Гидролиз. Электролиз
Типы реакций в неорганической химии. Гидролиз. Электролиз Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Первое начало термодинамики (Закон сохранения и превращения энергии)
Первое начало термодинамики (Закон сохранения и превращения энергии) Основы МКТ
Основы МКТ Декоративная краска с эффектом окисленной меди
Декоративная краска с эффектом окисленной меди Техника безопасности на уроках химии
Техника безопасности на уроках химии Анализ воды природных источников посёлков Фруктовая и Красная Пойма городского округа Луховицы
Анализ воды природных источников посёлков Фруктовая и Красная Пойма городского округа Луховицы Создание учебно-методических материалов по химии в современной форме (презентации уроков)
Создание учебно-методических материалов по химии в современной форме (презентации уроков) Экстракционное разделение радионуклидов
Экстракционное разделение радионуклидов Кислотно-основные равновесия в растворах
Кислотно-основные равновесия в растворах Опасная бытовая химия!
Опасная бытовая химия! Типичные экспериментальные кинетические данные
Типичные экспериментальные кинетические данные Календарь юного химика. 2013-2014 учебный год
Календарь юного химика. 2013-2014 учебный год Презентация по Химии "Электрохимический ряд напряжений металлов. Общие химические свойства металлов"
Презентация по Химии "Электрохимический ряд напряжений металлов. Общие химические свойства металлов"  Металлы
Металлы Положение металлов в периодической системе Д.И. Менделеева. Физические свойства металлов
Положение металлов в периодической системе Д.И. Менделеева. Физические свойства металлов Высшие жирные кислоты липиды биомембраны. Лекция 3
Высшие жирные кислоты липиды биомембраны. Лекция 3 Презентация на тему Теория строения химических соединений А.М.Бутлерова
Презентация на тему Теория строения химических соединений А.М.Бутлерова  Количество вещества. Моль
Количество вещества. Моль Презентация на тему Электролиз: что полезно знать
Презентация на тему Электролиз: что полезно знать  Уравнения химических реакций
Уравнения химических реакций