Содержание
- 2. Цели урока составлять уравнения электролитической диссоциации кислот составлять уравнения электролитической диссоциации щелочей
- 3. одна молекула азотной кислоты: катион водорода и нитрат-анион две молекулы азотной кислоты: катион водорода и нитрат-анион
- 4. Диссоциация серной кислоты
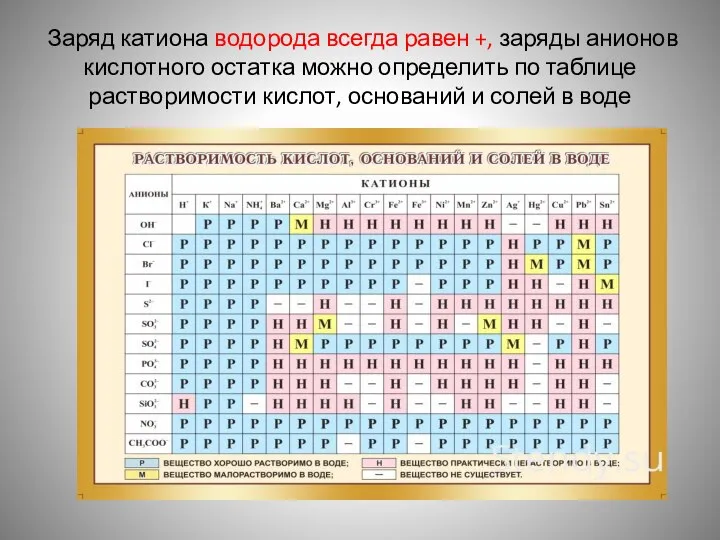
- 5. Заряд катиона водорода всегда равен +, заряды анионов кислотного остатка можно определить по таблице растворимости кислот,
- 6. Запомни!!!
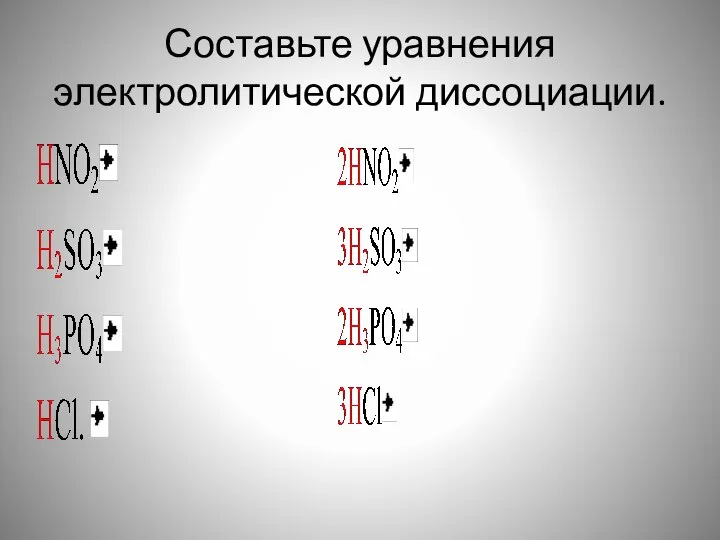
- 7. Составьте уравнения электролитической диссоциации.
- 8. Основания это сложные вещества при диссоциации которых в водных растворах образуются катионы металлов и гидроксид –
- 9. Запомни!!! не диссоцируют (не распадаются на ионы) нерастворимые основания. Например: Zn(OH)2, Al(OH)3 См. Таблицу растворимости
- 11. Скачать презентацию






 Радиоактивность. Тест
Радиоактивность. Тест Вещества молекулярного и немолекулярного строения
Вещества молекулярного и немолекулярного строения Основания
Основания Природные источники углеводородов
Природные источники углеводородов ОВР - метод полуреакции
ОВР - метод полуреакции Неметаллы. Особенности электронного строения атомов НМ
Неметаллы. Особенности электронного строения атомов НМ Сокровища соляных дворцов
Сокровища соляных дворцов Жиры. Сложные эфиры
Жиры. Сложные эфиры Пищевая сода
Пищевая сода Химическая связь
Химическая связь Окислительно=восстановительное титрование
Окислительно=восстановительное титрование Технология получения красного фосфора
Технология получения красного фосфора Соединения железа
Соединения железа Водородные соединения неметаллов
Водородные соединения неметаллов Альдегиды. Получение и применение. Общая формула альдегидов
Альдегиды. Получение и применение. Общая формула альдегидов Сильные и слабые кислоты и основания
Сильные и слабые кислоты и основания Изучение микроклимата коровника с целью создания системы очистки воздуха от аммиака
Изучение микроклимата коровника с целью создания системы очистки воздуха от аммиака Теоретические основы каталитических процессов переработки нефтегазового сырья. Тема 6
Теоретические основы каталитических процессов переработки нефтегазового сырья. Тема 6 Водородная химическая связь
Водородная химическая связь Периодическая система Д.И.Менделеева
Периодическая система Д.И.Менделеева rastvory_-_kopia
rastvory_-_kopia Химические реакции
Химические реакции 13.10 Презентация по химии на тему _Валентность_ (11 класс)
13.10 Презентация по химии на тему _Валентность_ (11 класс) Применение ЦОР на уроках биологии и химии
Применение ЦОР на уроках биологии и химии Сера и его соединения
Сера и его соединения Реакции неполного окисления в органике
Реакции неполного окисления в органике Тестирование по химии
Тестирование по химии Эфирные масла
Эфирные масла