Содержание
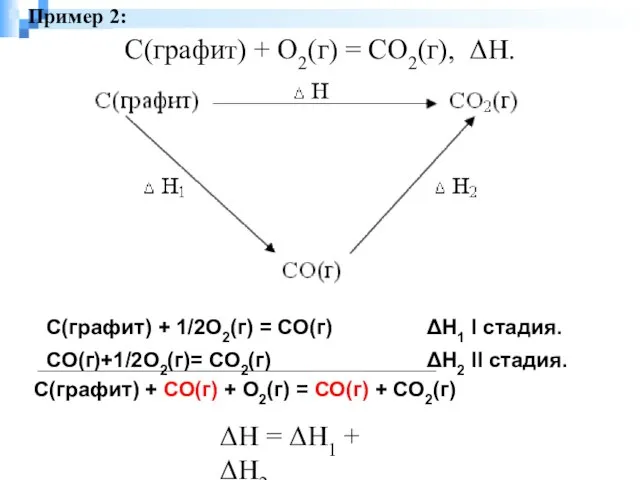
- 2. С(графит) + О2(г) = СО2(г), ΔН. ΔН = ΔН1 + ΔН2 Пример 2:
- 3. Пример 3: Рассчитайте тепловой эффект реакции горения аммиака: 4NН3 (г) + 3О2 (г) = 2N2 (г)
- 4. Пример 4:
- 5. Пример 5:
- 6. Пример 6: Гомогенные реакции: 2SO2(г) + O2(г) = 2SO3(г) υ = k ·c(SO2)2·c(O2) Гетерогенные реакции: С(тв)
- 7. Пример 7. Как изменится скорость реакции, протекающей в газовой фазе, если температуру уменьшить от 60°С до
- 8. Смещение химического равновесия Принцип Ле-Шателье При изменении внешних условий химическое равновесие смещается в сторону той реакции
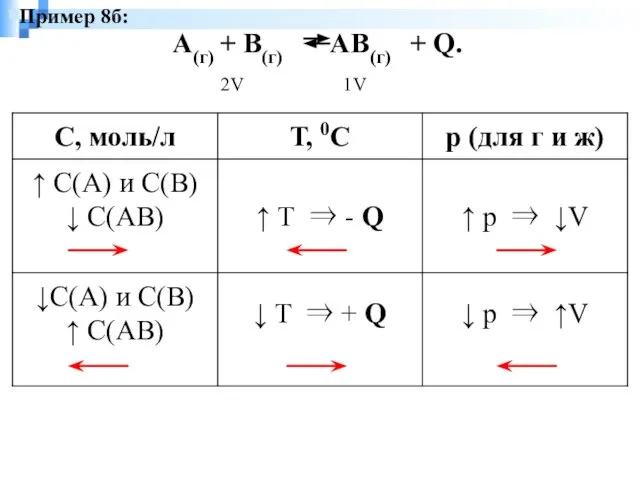
- 9. А(г) + В(г) АВ(г) + Q. 2V 1V Пример 8б:
- 11. Скачать презентацию






 Среды для культивирования эмбрионов-история разработки и составы
Среды для культивирования эмбрионов-история разработки и составы Классификация органических соединений. Предельные углеводороды (УВ)
Классификация органических соединений. Предельные углеводороды (УВ) Алкены (олефины)
Алкены (олефины) Силикатная промышленность: Вчера, сегодня, завтра
Силикатная промышленность: Вчера, сегодня, завтра Химия и автомобиль
Химия и автомобиль Генетическая связь неорганических соединений
Генетическая связь неорганических соединений Скорость химической реакции
Скорость химической реакции Химия окружающей среды
Химия окружающей среды Минерал гранат
Минерал гранат Čo sú chemické reakcie
Čo sú chemické reakcie Новогодний Пробник №190415
Новогодний Пробник №190415 Кислоты
Кислоты Кислородные соединения углерода
Кислородные соединения углерода Химические формулы
Химические формулы Химик (Химическая реакция реакция или химическое явление)
Химик (Химическая реакция реакция или химическое явление) Органическая химия
Органическая химия Элементы и атомы, В менделеевский взяты круг Сделали химию самой богатой И самой творческой из наук.
Элементы и атомы, В менделеевский взяты круг Сделали химию самой богатой И самой творческой из наук. Железо
Железо Электролитическая диссоциация веществ
Электролитическая диссоциация веществ Презентация на тему Чистые вещества и смеси. Химический диктант
Презентация на тему Чистые вещества и смеси. Химический диктант  Алкадиены
Алкадиены Ð_еÑ_еÑ_огенное Ñ_авн (1)
Ð_еÑ_еÑ_огенное Ñ_авн (1) Кислоты
Кислоты Общая характеристика элементов IIА группы
Общая характеристика элементов IIА группы Свойства белков
Свойства белков Типы кристаллических решеток
Типы кристаллических решеток Названия и формулы кислот
Названия и формулы кислот Общая химическая технология. Составление материального баланса технологического процесса. Практическое занятие 6
Общая химическая технология. Составление материального баланса технологического процесса. Практическое занятие 6