Содержание
- 2. ЛЕКЦИЯ № 2 ОСНОВНЫЕ ПОНЯТИЯ ФИЗИЧЕСКОЙ ХИМИИ
- 3. Предмет физической химии – химические процессы и сопровождающие из физические явления, различные виды энергии, которые сопровождают
- 4. Раздел химии, изучающий энергетику и направление химических реакций, называется термодинамикой (ТД). Приоритет в открытии и разработке
- 5. Энергия системы − общая количественная мера движения материи. Система − любой объект природы, отделенный от других
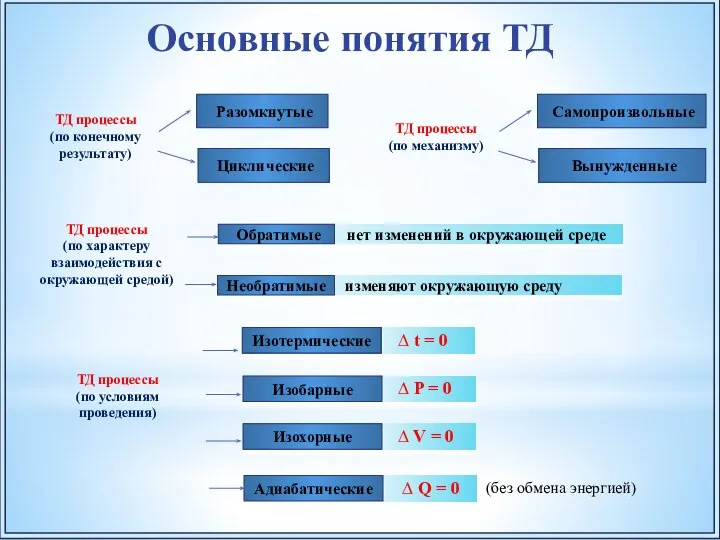
- 6. ТД процессы (по конечному результату) Разомкнутые Циклические Основные понятия ТД ТД процессы (по характеру взаимодействия с
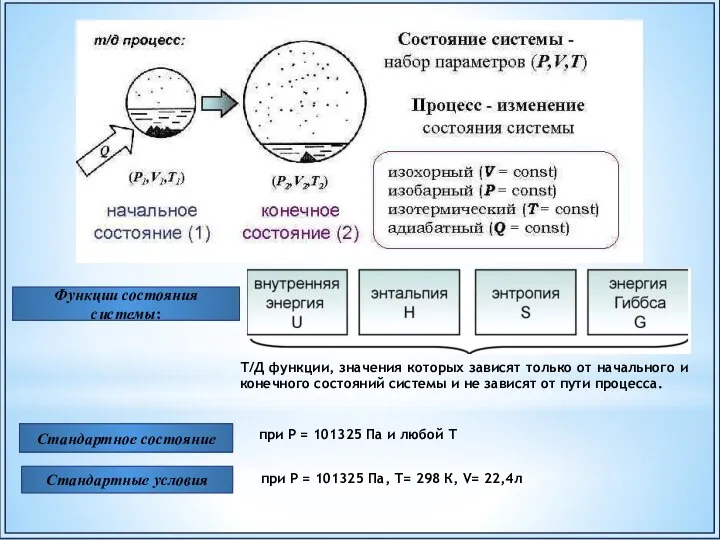
- 7. Состояние системы Термодинамические (ТД) параметры: Термодинамический (ТД) процесс − всякое изменение в системе, связанное с изменением
- 8. Стандартное состояние Функции состояния системы: Стандартные условия Т/Д функции, значения которых зависят только от начального и
- 9. В любом процессе соблюдается ЗАКОН СОХРАНЕНИЯ ЭНЕРГИИ − первое начало термодинамики. Напомним, что энергия − это
- 10. Химические процессы, как правило, протекают при постоянном давлении (P = сonst, изобарный процесс). Для изобарного процесса
- 11. Для изохорного процесса, изменения объёма не происходит, работа расширения равна нулю, поэтому: Qv = U2 -
- 12. Связь между изобарным и изохорным тепловыми эффектами: ΔH = ΔU + РΔV или ΔH = ΔU
- 13. Тепловые эффекты реакций определяют как экспериментально (калориметрическим методом), так и с помощью термохимических расчетов. В основе
- 14. Из закона Гесса вытекает ряд следствий, которые важны для термохимических расчетов: ПЕРВОЕ СЛЕДСТВИЕ: Тепловой эффект реакции
- 15. ВТОРОЕ СЛЕДСТВИЕ: Тепловой эффект реакции равен сумме теплот сгорания исходных веществ (∆Нсгор.) за вычетом суммы теплот
- 16. Под стандартной теплотой образования Н0обр 298 понимают тепловой эффект образования 1 моль вещества из простых веществ
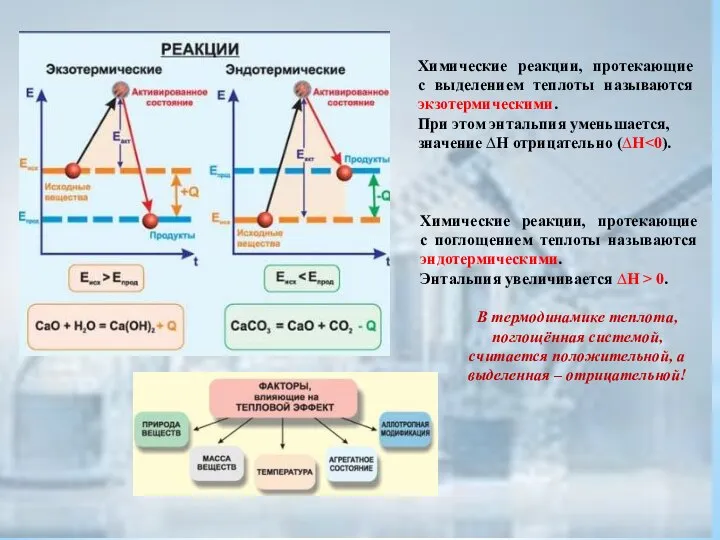
- 17. Химические реакции, протекающие с выделением теплоты называются экзотермическими. При этом энтальпия уменьшается, значение ∆H отрицательно (∆H
- 18. Запись химической реакции с указанием теплового эффекта называется ТЕРМОХИМИЧЕСКИМ УРАВНЕНИЕМ: ½ Н2 (г) + ½ Cl2
- 19. Для решения вопросов о направлении химической реакции используют второе начало термодинамики. Основоположником считается французский физик Карно
- 20. Вывод: ПРОТЕКАНИЕ САМОПРОИЗВОЛЬНЫХ ПРОЦЕССОВ В ИЗОЛИРОВАННОЙ СИСТЕМЕ СОПРОВОЖДАЕТСЯ РАССЕИВАНИЕМ ТЕПЛОВОЙ ЭНЕРГИИ. Для характеристики рассеянной энергии в
- 21. Мерой неупорядоченности или вероятности состояния служит функция – энтропия, она пропорциональна логарифму вероятности нахождения вещества в
- 22. Например, если удалить перегородку, разделяющую две изолированные системы, не изменяя внутреннюю энергию, то происходит самопроизвольное равномерное
- 23. S = S2 – S1 = K·ln W2 / W1 W2 > W1 → ∆S >
- 24. Критерием самопроизвольного протекания процесса является энергия Гиббса. Направление химических реакций определяется одновременным действием двух факторов: тенденцией
- 25. По изменению энергии Гиббса можно судить о возможности протекания процесса. ∆G > 0, то самопроизвольного протекания
- 26. При расчетах используется стандартный изобарно–изотермический потенциал ∆G0обр.298 , т.е. изменение энергии Гиббса при образовании 1 моль
- 27. ПОДВЕДЁМ ИТОГ: ТД функции состояния системы могут быть рассчитаны по общей схеме: ТД функция (хим. реакции)
- 28. Химическая кинетика − учение о скорости химических реакций и зависимости ее от различных факторов − природы
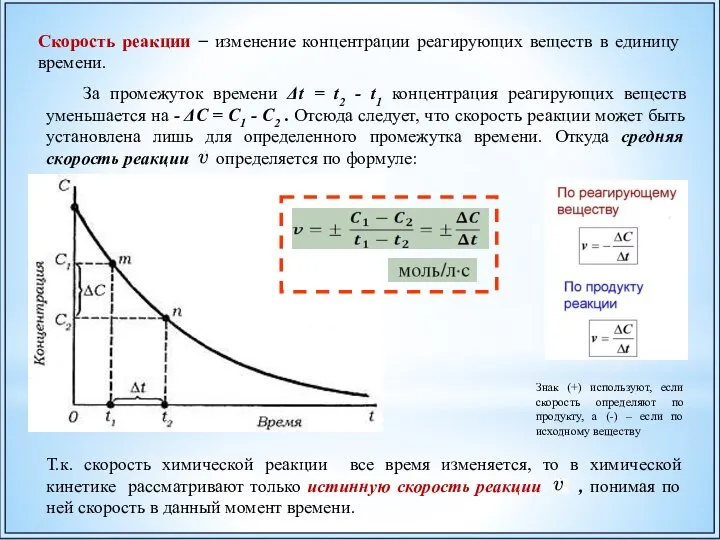
- 29. Скорость реакции − изменение концентрации реагирующих веществ в единицу времени. За промежуток времени Δt = t2
- 30. Например: С1 = 1 моль/л С2 = 0,6 моль/л t2 = 4c = (1-0,6)/4= 0,1 моль/л
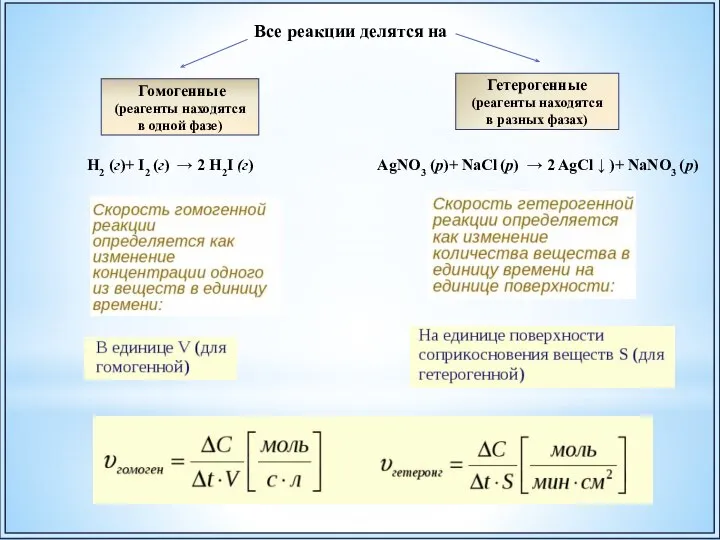
- 32. Гомогенные (реагенты находятся в одной фазе) Гетерогенные (реагенты находятся в разных фазах) Все реакции делятся на
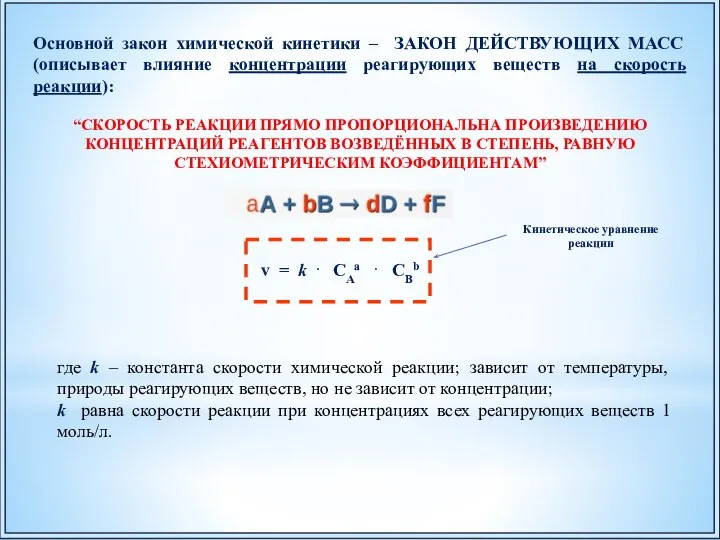
- 33. v = k . CAa . CBb Основной закон химической кинетики – ЗАКОН ДЕЙСТВУЮЩИХ МАСС (описывает
- 34. Реакции между молекулами протекают обычно медленно, между ионами и радикалами – быстро: Природу реагирующих веществ учитывает
- 35. Где vt2 – скорость химической реакции при температуре на 10 0C выше, чем начальная скорость vt1
- 37. Правило Вант-Гоффа, справедливо только для узкого интервала температур. Точная зависимость константы скорости от температуры выражается уравнением
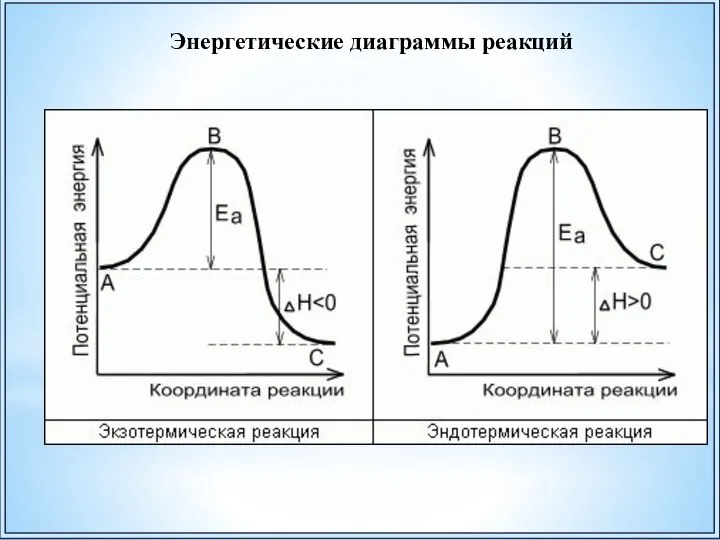
- 38. Энергетические диаграммы реакций
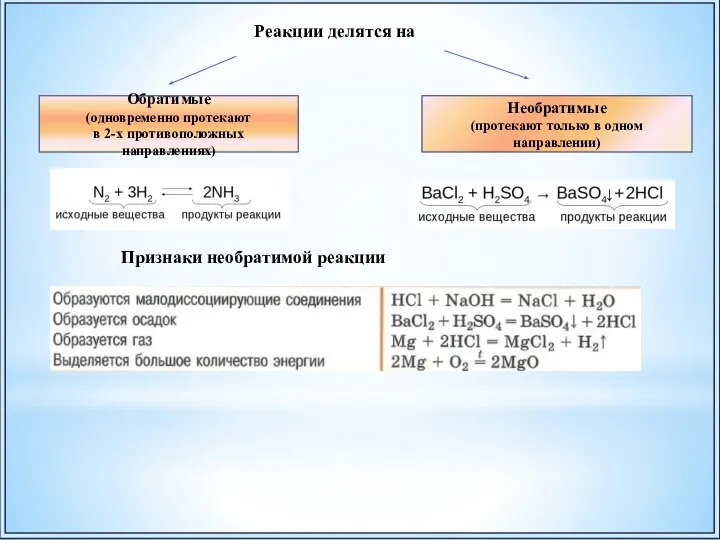
- 39. Обратимые (одновременно протекают в 2-х противоположных направлениях) Необратимые (протекают только в одном направлении) Реакции делятся на
- 40. Состояние системы, при котором скорость прямой реакции равна скорости обратной реакции, называется химическим равновесием.
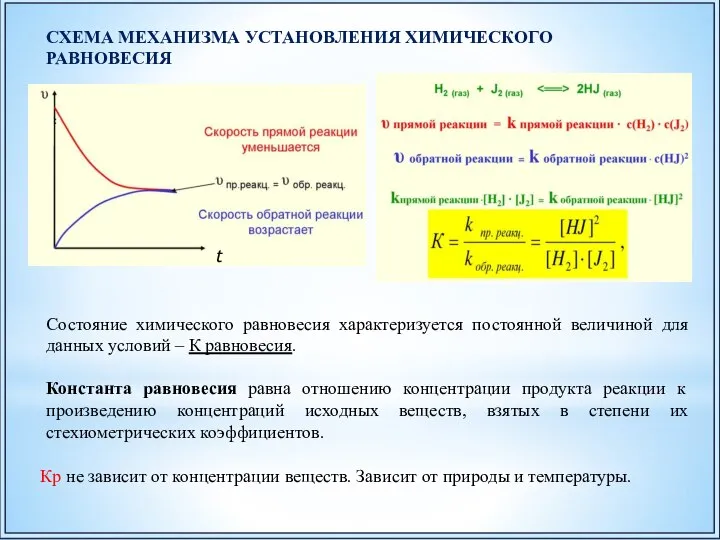
- 41. t СХЕМА МЕХАНИЗМА УСТАНОВЛЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ Состояние химического равновесия характеризуется постоянной величиной для данных условий –
- 42. Концентрации твердых веществ считают неизменными и в выражение Кр не включают. КОНСТАНТЫ РАВНОВЕСИЙ В ГОМОГЕННЫХ И
- 43. Примеры решения задач Вычислите равновесные концентрации [NO] и [O2] и константу равновесия реакции если исходные концентрации
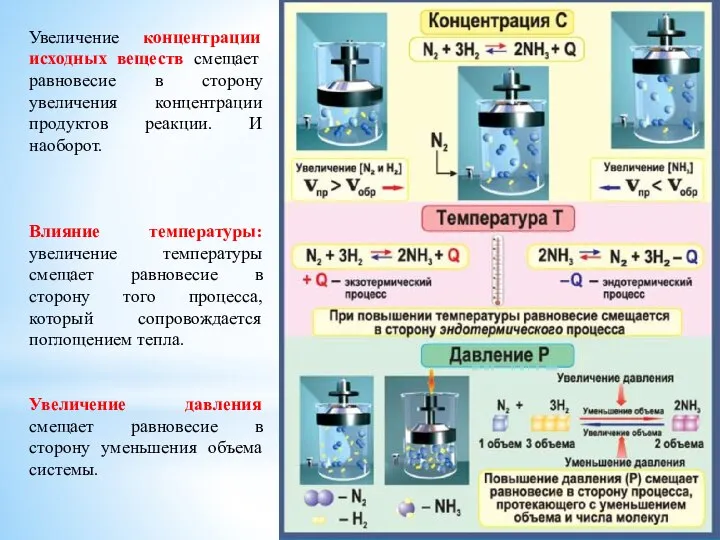
- 44. СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ ЕСЛИ НА СИСТЕМУ, НАХОДЯЩУЮСЯ В СОСТОЯНИИ РАВНОВЕСИЯ ОКАЗАТЬ КАКОЕ-ЛИБО ВНЕШНЕЕ ВОЗДЕЙСТВИЕ, ТО РАВНОВЕСИЕ
- 45. Увеличение концентрации исходных веществ смещает равновесие в сторону увеличения концентрации продуктов реакции. И наоборот. Влияние температуры:
- 46. Каталитические реакции Катализ – процесс изменения скорости химической реакции за счет введения в реакционную систему веществ,
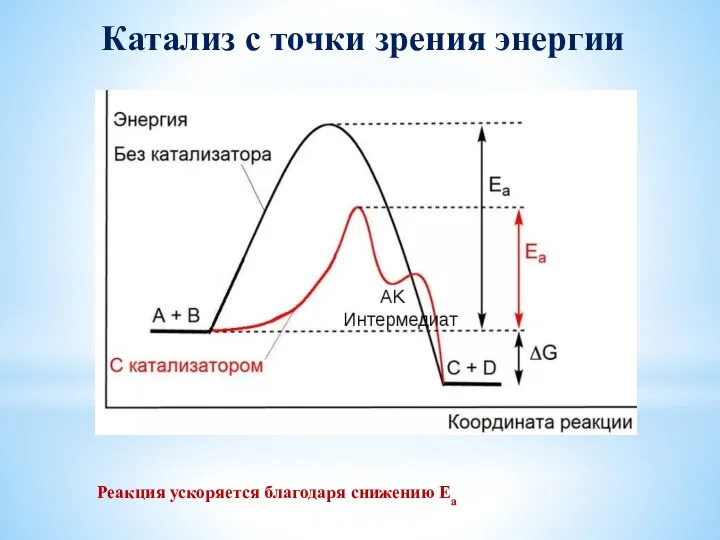
- 47. Катализ с точки зрения энергии Реакция ускоряется благодаря снижению Еа
- 48. ГОМОГЕННЫЙ КАТАЛИЗ NO(г) 2SO2(г) + O2(г) ↔ 2SO3(г) 1 стадия: 2NO + O2 ↔ 2NO2 2
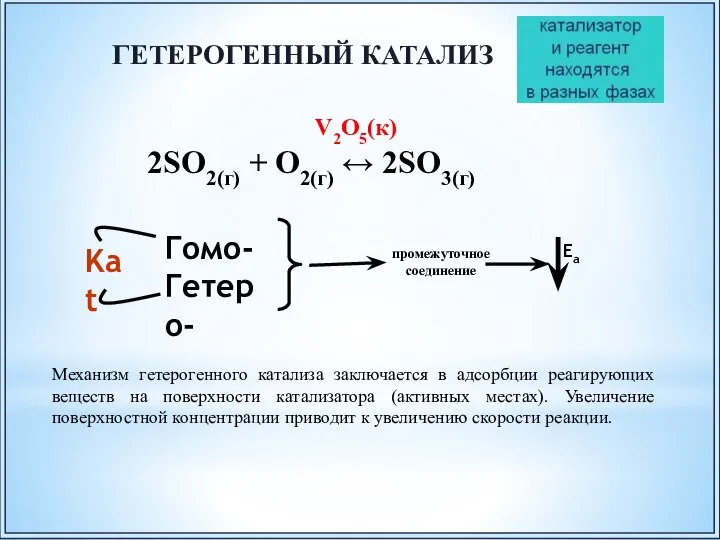
- 49. V2O5(к) 2SO2(г) + O2(г) ↔ 2SO3(г) ГЕТЕРОГЕННЫЙ КАТАЛИЗ Механизм гетерогенного катализа заключается в адсорбции реагирующих веществ
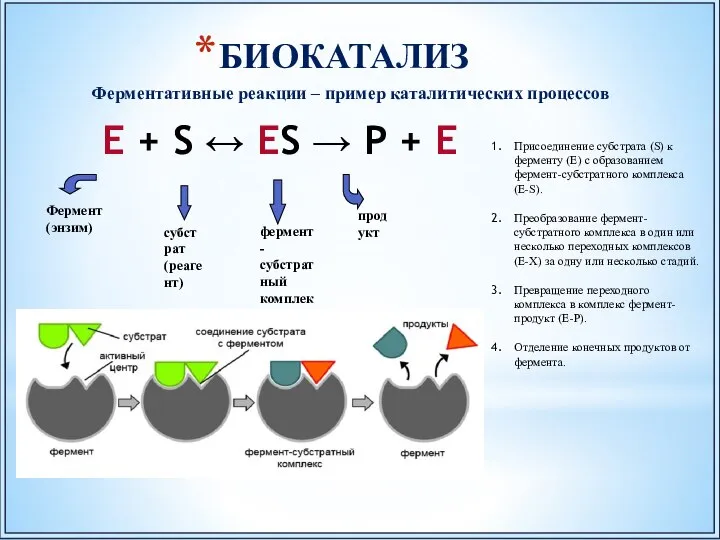
- 50. БИОКАТАЛИЗ E + S ↔ ES → P + E Ферментативные реакции – пример каталитических процессов
- 51. Высокая каталитическая активность ферментов (в сотни раз активнее неорганических катализаторов). Биокатализаторы в отличие от неорганических катализаторов
- 53. Скачать презентацию
































![Примеры решения задач Вычислите равновесные концентрации [NO] и [O2] и константу равновесия](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1137992/slide-42.jpg)




 Электролитическая диссоциация. Электролиты и неэлектролиты
Электролитическая диссоциация. Электролиты и неэлектролиты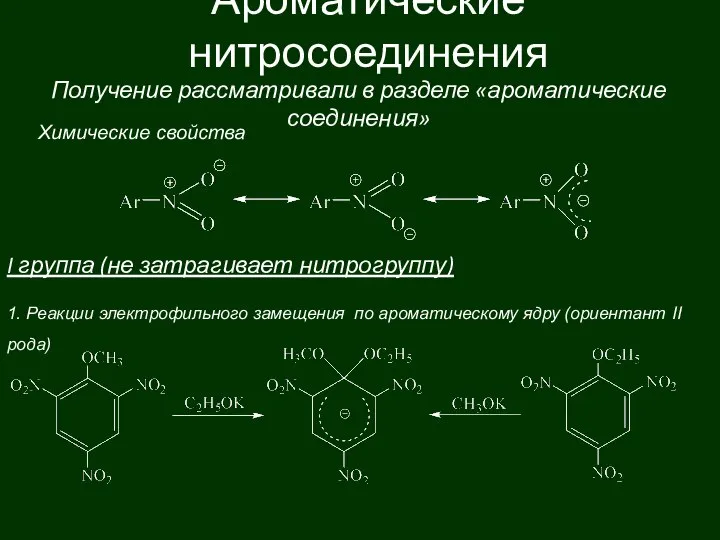 Ароматические нитросоединения
Ароматические нитросоединения Несовершенства и дефекты кристаллической решетки полимеров
Несовершенства и дефекты кристаллической решетки полимеров Никель и его соединения
Никель и его соединения Основные классы неорганических веществ
Основные классы неорганических веществ Комплексные соединения
Комплексные соединения Структура металлов, сплавов, интерметаллидов и квазикристаллов
Структура металлов, сплавов, интерметаллидов и квазикристаллов Степень окисления. Электроотрицательность. Формулы бинарных соединений
Степень окисления. Электроотрицательность. Формулы бинарных соединений Презентация на тему Изомерия
Презентация на тему Изомерия  Фосфолипиды. Глицерофосфолипиды. Сфингофосфолипиды. Гликолипиды
Фосфолипиды. Глицерофосфолипиды. Сфингофосфолипиды. Гликолипиды Оксид цинка ZnO
Оксид цинка ZnO Расчётно-графическая работа по теме Мыловарение
Расчётно-графическая работа по теме Мыловарение Биохимия витаминов и коферментов
Биохимия витаминов и коферментов Применение алкенов
Применение алкенов Химические реакции в органической химии
Химические реакции в органической химии Презентация на тему Теория строения органических соединений А. М. Бутлерова
Презентация на тему Теория строения органических соединений А. М. Бутлерова  Энергия Гиббса
Энергия Гиббса Получение армированных фотополимерных композиций
Получение армированных фотополимерных композиций Алканы
Алканы Химия. Зачем она нужна? Дистанционный конкурс «Химия без лаборатории» Ученица 10 класса Климашина Василиса, ГОУСОШ № 464 – ЦАО, г. М
Химия. Зачем она нужна? Дистанционный конкурс «Химия без лаборатории» Ученица 10 класса Климашина Василиса, ГОУСОШ № 464 – ЦАО, г. М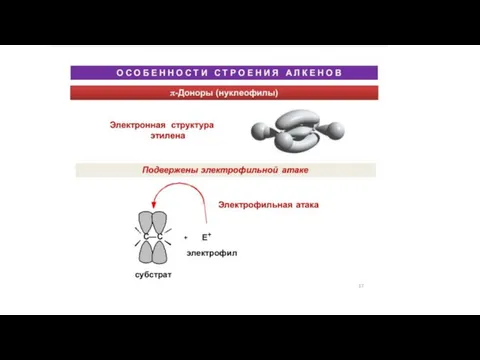 Особенности строения алкенов
Особенности строения алкенов Получение функциональных плёнок на основе TiO2
Получение функциональных плёнок на основе TiO2 Сколько нужно чистого белка
Сколько нужно чистого белка Дивный мир турмалинов
Дивный мир турмалинов Кислородсодержащие органические вещества
Кислородсодержащие органические вещества Эмульсии как лиофобные дисперсные системы
Эмульсии как лиофобные дисперсные системы Министерство сельского хозяйства Российской Федерации. Поляграфия и фотоэлектронная спектроскопия
Министерство сельского хозяйства Российской Федерации. Поляграфия и фотоэлектронная спектроскопия Презентация по Химии "Незнайка в стране химия"
Презентация по Химии "Незнайка в стране химия"