Содержание
- 2. Химическое равновесие. Принцип Ле Шателье Цель урока: познакомиться с понятием «химическое равновесие», принципом Ле Шателье, а
- 3. Задачи урока: 1) сформировать знания о химическом равновесии - состоянии, которое неизбежно наступает при протекании обратимой
- 4. Необратимые реакции BaCl2 + H2SO4 → BaSO4 + 2HCl исходные вещества продукты реакции Необратимые реакции -
- 5. Обратимые реакции N2 + 3H2 2NH3 исходные вещества продукты реакции Обратимые реакции - это химические реакции,
- 6. ν1 SO2 + H2O H2SO3 ν2 где: ν1 – прямая реакция (идет в сторону образования продуктов
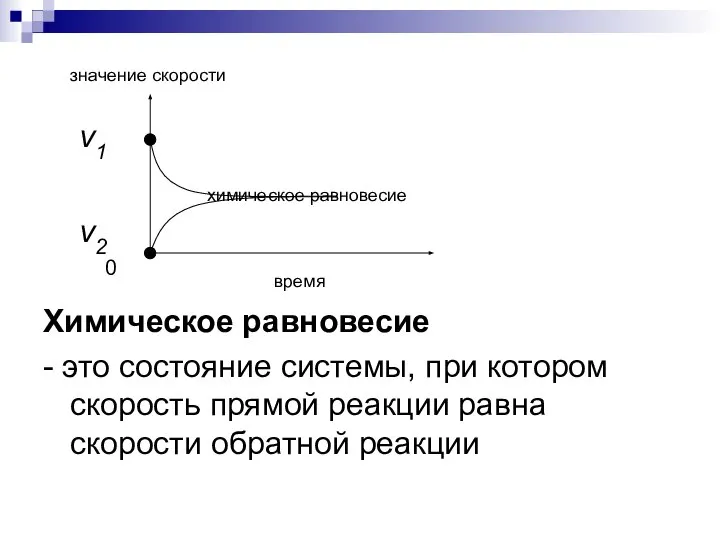
- 7. значение скорости ν1 химическое равновесие ν2 0 время Химическое равновесие - это состояние системы, при котором
- 8. Принцип Ле Шателье при изменении внешних условий химическое равновесие смещается в строну той реакции, которая ослабляет
- 9. Влияние температуры 2SO2 + O2 2SO3 + Q (2SO3 2SO2 + O2 – Q)
- 10. Влияние давления 2SO2 + O2 2SO3 + Q 2V + 1V 2V
- 11. Влияние концентрации
- 12. aA + bB dD + fF [D]d . [F]f Kp = ----------- [A]a . [B]b где:
- 14. Скачать презентацию









![aA + bB dD + fF [D]d . [F]f Kp = -----------](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/956412/slide-11.jpg)
 Основой для расчета реакторов с учетом теплового режима служит уравнение теплового баланса
Основой для расчета реакторов с учетом теплового режима служит уравнение теплового баланса Неметаллы. Общая характеристика
Неметаллы. Общая характеристика Химическая связь и строение молекул
Химическая связь и строение молекул Вспоминаем химию
Вспоминаем химию Типичные реакции основных и кислотных оксидов
Типичные реакции основных и кислотных оксидов Электрохимия. Электролиты
Электрохимия. Электролиты Салқындатқыш агенттер
Салқындатқыш агенттер Скорость химической реакции
Скорость химической реакции Что объединяет вкус яблока, киви, садовой земляники?
Что объединяет вкус яблока, киви, садовой земляники? Изотерма адсорбции. Связь изотермы, изопикны и изостеры адсорбции. Закон Генри. Лекция 6
Изотерма адсорбции. Связь изотермы, изопикны и изостеры адсорбции. Закон Генри. Лекция 6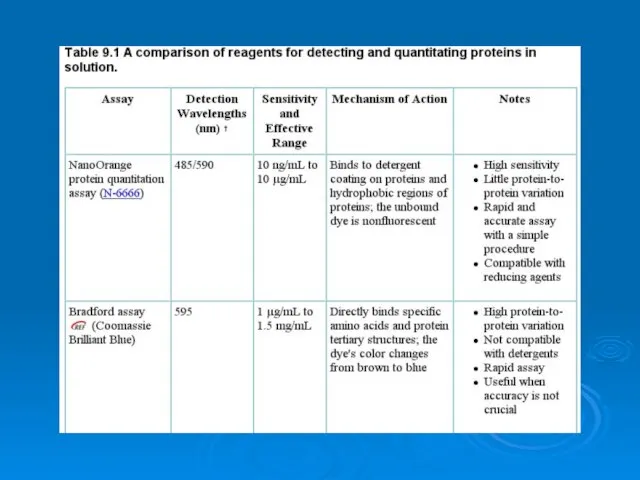 Analysis of proteins
Analysis of proteins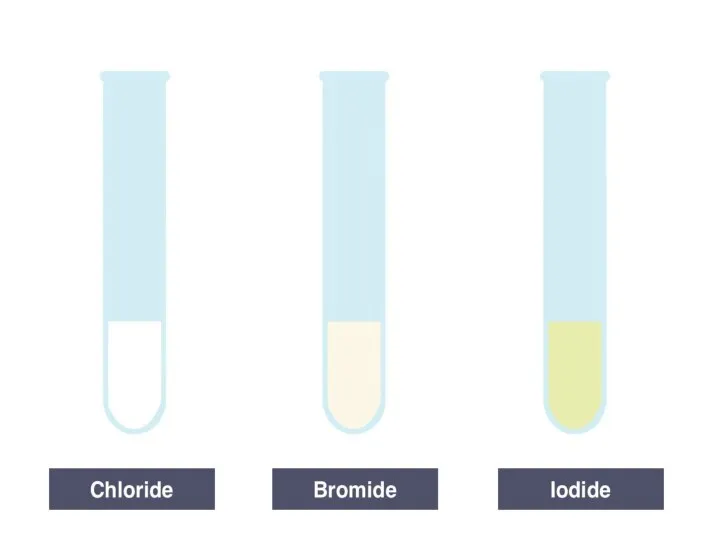 Определение галогенид-ионов в водном растворе. Лабораторный опыт
Определение галогенид-ионов в водном растворе. Лабораторный опыт 9_OSNOVY_KOLANALIZA (1)
9_OSNOVY_KOLANALIZA (1) Природные источники углеводородов
Природные источники углеводородов Химия и искусство: техника офорт
Химия и искусство: техника офорт лекция 1-к.н.с.-ИАИТ-2022
лекция 1-к.н.с.-ИАИТ-2022 Соли: классификация, получение, номенклатура
Соли: классификация, получение, номенклатура Презентация на тему Аминокислоты и белки: строение и свойства
Презентация на тему Аминокислоты и белки: строение и свойства  Презентация на тему Барометр анероид
Презентация на тему Барометр анероид 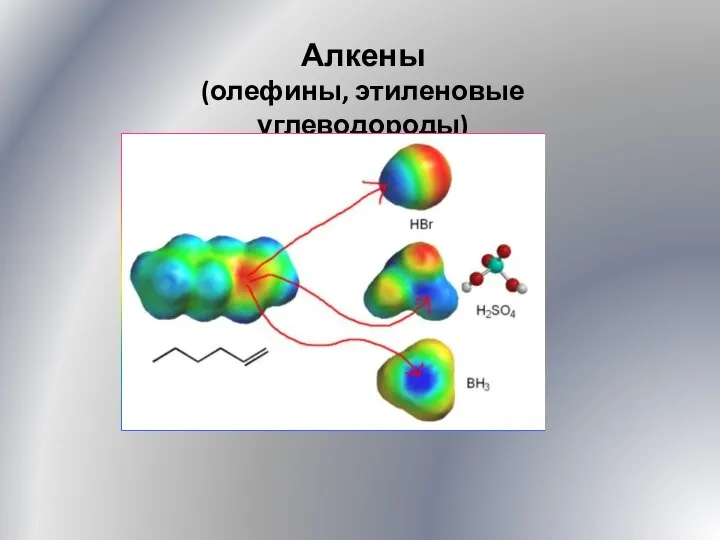 Алкены. Олефины, этиленовые углеводороды. (Лекция 5)
Алкены. Олефины, этиленовые углеводороды. (Лекция 5) Теория электролитической диссоциации
Теория электролитической диссоциации Физические свойства элементов 2 (ІІ) - группы
Физические свойства элементов 2 (ІІ) - группы Презентация на тему Всё о кремнии
Презентация на тему Всё о кремнии  Алкадиены: строение, номенклатура, гомологи, изомерия
Алкадиены: строение, номенклатура, гомологи, изомерия Сложные эфиры
Сложные эфиры Осаждение нитрида кремния
Осаждение нитрида кремния Мышьяк. Висмут. Сурьма
Мышьяк. Висмут. Сурьма Лаки. Эмали. Красочные составы
Лаки. Эмали. Красочные составы