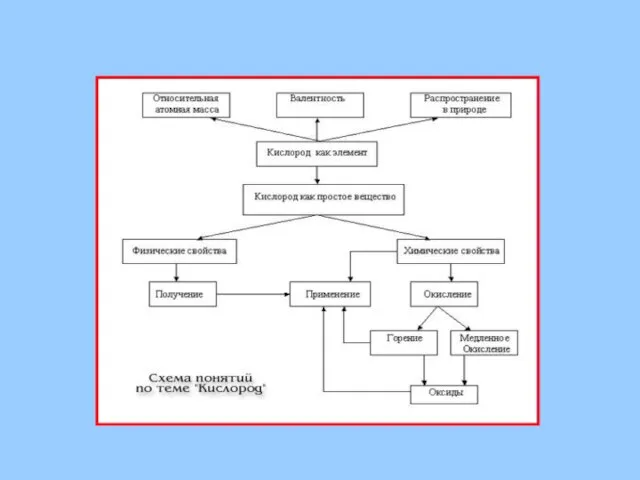
Содержание
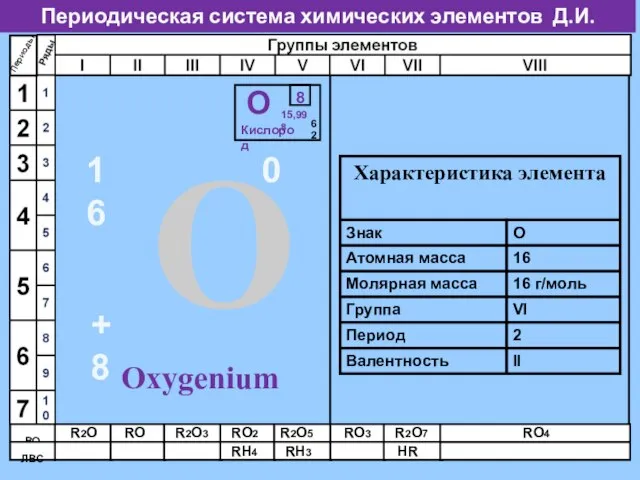
- 4. Периодическая система химических элементов Д.И. Менделеева Периоды ВО ЛВС R2O RO R2O3 RO2 R2O5 RO3 R2O7
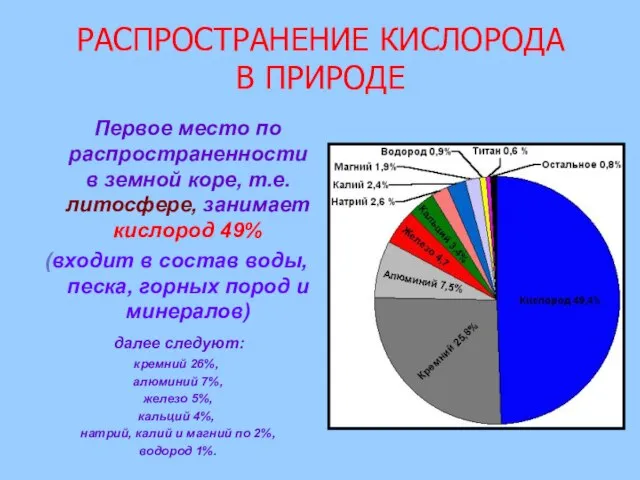
- 5. РАСПРОСТРАНЕНИЕ КИСЛОРОДА В ПРИРОДЕ Первое место по распространенности в земной коре, т.е. литосфере, занимает кислород 49%
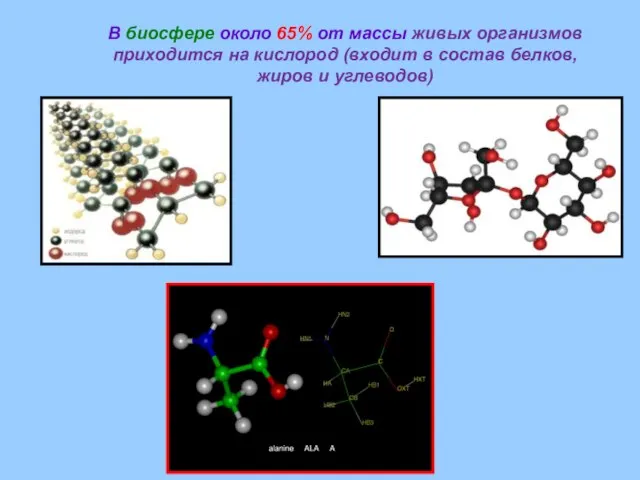
- 6. В биосфере около 65% от массы живых организмов приходится на кислород (входит в состав белков, жиров
- 7. В гидросфере на его долю приходится 89%.
- 8. Простое вещество кислород
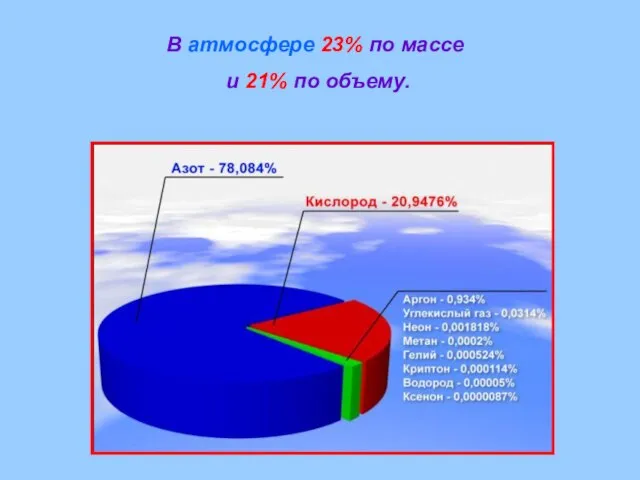
- 9. В атмосфере 23% по массе и 21% по объему.
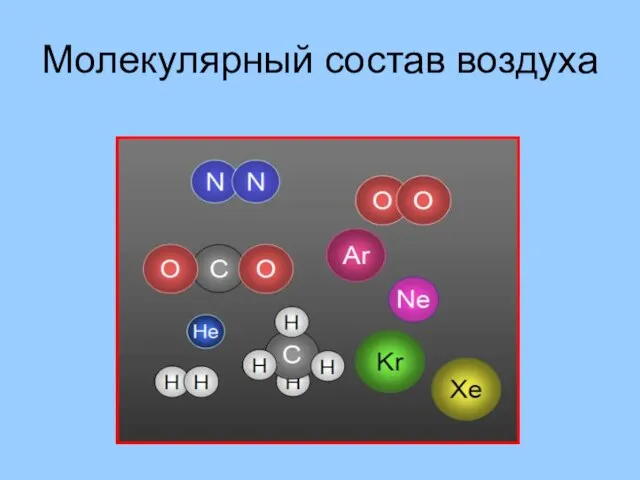
- 10. Молекулярный состав воздуха
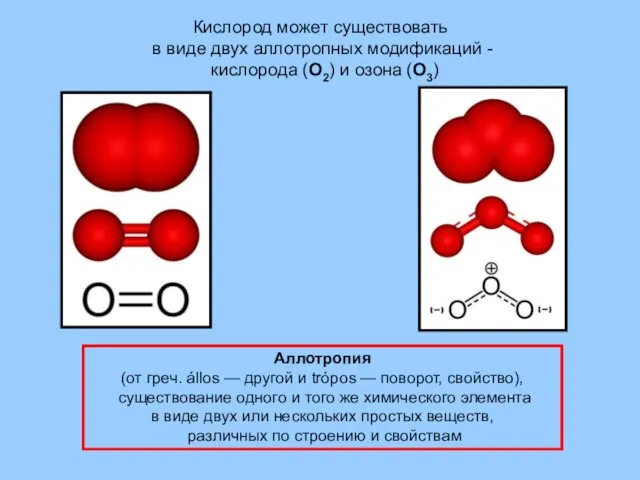
- 11. Кислород может существовать в виде двух аллотропных модификаций - кислорода (О2) и озона (О3) Аллотропия (от
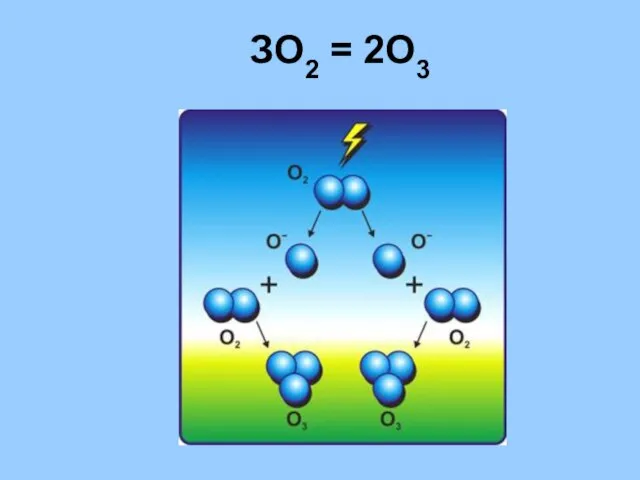
- 12. ЗО2 = 2О3
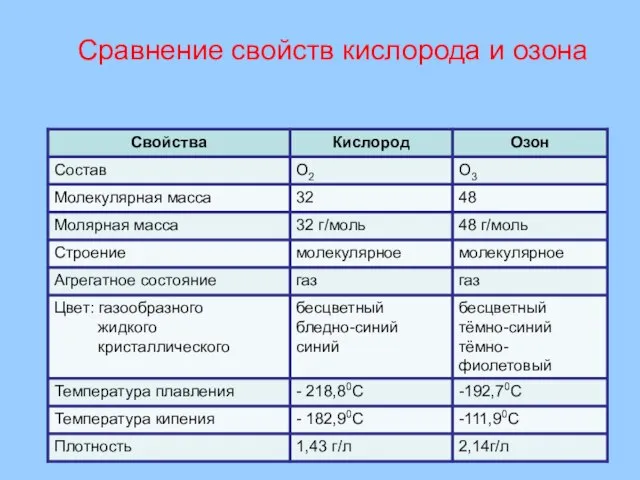
- 13. Сравнение свойств кислорода и озона
- 14. Первые сведения найдены в Европе из китайских рукописей 8 в; В начале 16 в. Леонардо да
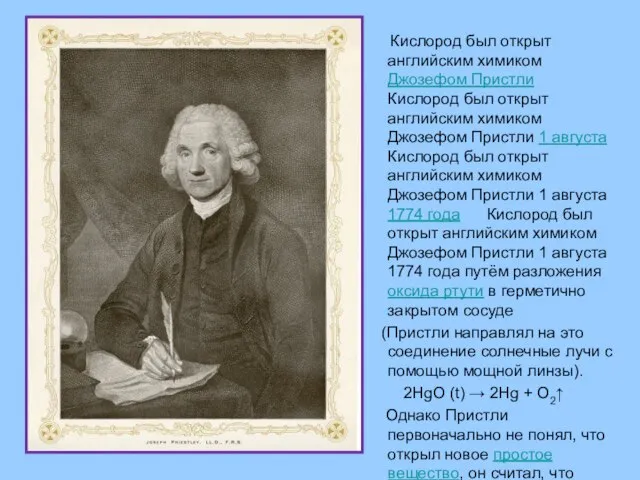
- 15. Кислород был открыт английским химиком Джозефом Пристли Кислород был открыт английским химиком Джозефом Пристли 1 августа
- 16. О своём открытии Пристли сообщил выдающемуся французскому химику Антуану Лавуазье. В 1775 году А. Лавуазье установил,
- 17. Несколькими годами ранее (в 1771 годуНесколькими годами ранее (в 1771 году) кислород получил шведский химик Карл
- 18. Получение кислорода в промышленности В промышленности кислород получают из воздуха. Воздух представляет собой смесь различных газов,
- 19. Жидкий кислород Газообразный кислород
- 20. Получение кислорода в лаборатории В лаборатории кислород получают из кислородсодержащих веществ путем их разложения при нагревании
- 21. При разложении пероксида водорода используют катализатор (MnO2) 2H2O2 =кат 2H2O + O2↑ Катализа́тор — химическое вещество
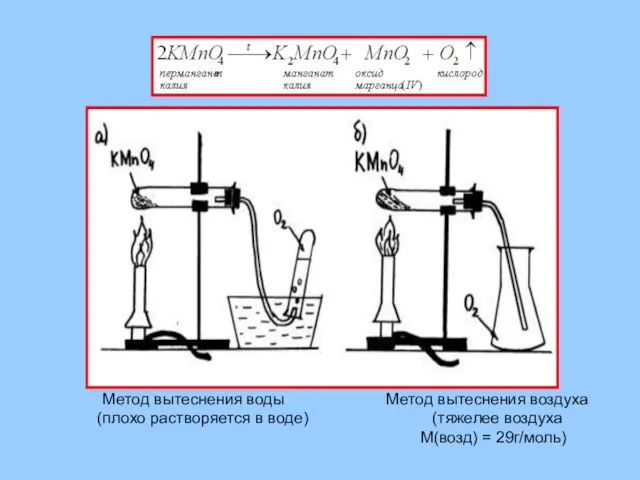
- 22. Получение из перманганата калия (марганцовки)
- 23. Метод вытеснения воды Метод вытеснения воздуха (плохо растворяется в воде) (тяжелее воздуха М(возд) = 29г/моль)
- 24. Как доказать, что полученный газ является кислородом?
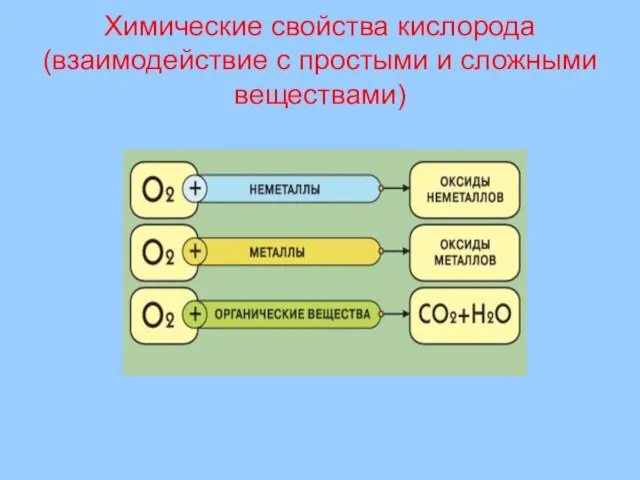
- 25. Химические свойства кислорода (взаимодействие с простыми и сложными веществами)
- 32. Взаимодействие кислорода с простыми веществами Взаимодействие с неметаллами (образуются оксиды неметаллов или кислотные оксиды) 2Н2 +
- 33. Взаимодействие кислорода со сложными веществами (образуются оксиды) Взаимодействие с неорганическими веществами: 2H2S + 3O2 = 2SO2
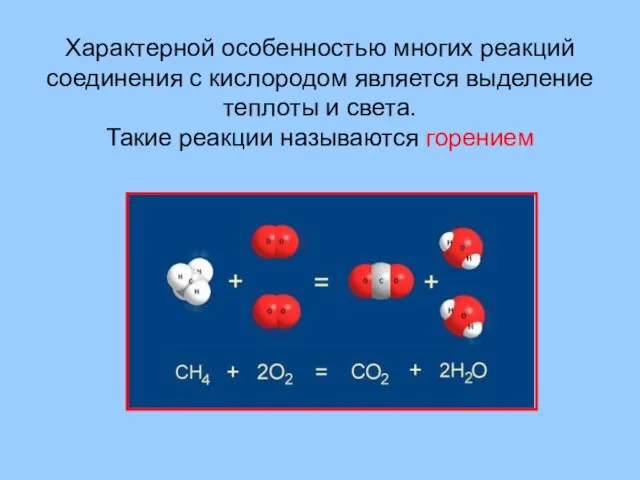
- 34. Характерной особенностью многих реакций соединения с кислородом является выделение теплоты и света. Такие реакции называются горением
- 37. Биологическая роль кислорода Большинство живых существ (аэробыБольшинство живых существ (аэробы) дышат кислородом воздуха. Широко используется кислород
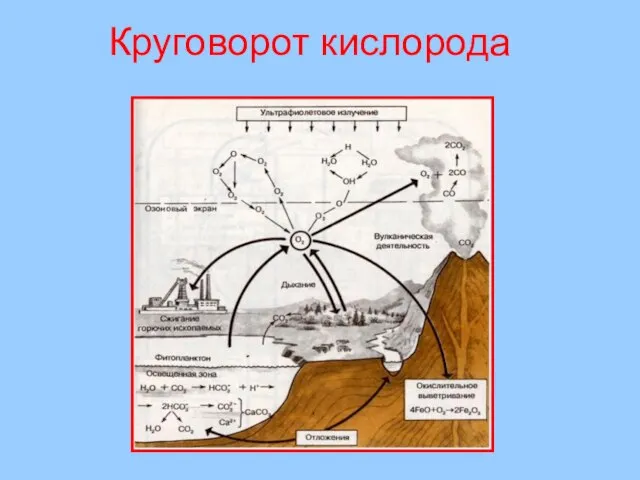
- 38. Круговорот кислорода
- 39. ПРИМЕНЕНИЕ КИСЛОРОДА ЧЕЛОВЕКОМ
- 41. Скачать презентацию
























 Кислотность почв с.Берёзовка МОУ «СОШ с.Берёзовка» Колесников Иван, 9 класс Пряхина Виктория, 8 класс
Кислотность почв с.Берёзовка МОУ «СОШ с.Берёзовка» Колесников Иван, 9 класс Пряхина Виктория, 8 класс Химические методы анализа. Аналитические методы контроля в техносферной безопасности. Лекция 6
Химические методы анализа. Аналитические методы контроля в техносферной безопасности. Лекция 6 Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Химическая реакция в потоке в одномерном случае. Уравнение неразрывности
Химическая реакция в потоке в одномерном случае. Уравнение неразрывности Химические свойства оксидов
Химические свойства оксидов Побочная подгруппа VII группы периодической системы
Побочная подгруппа VII группы периодической системы Многообразие органических веществ
Многообразие органических веществ Обозначения групп симметрии по Шенфлису
Обозначения групп симметрии по Шенфлису Клеящие материалы
Клеящие материалы Презентация на тему Обратимость химических реакций. Химическое равновесие
Презентация на тему Обратимость химических реакций. Химическое равновесие  Материаловедение. Адсорбционные материалы. Металлоорганические каркасы
Материаловедение. Адсорбционные материалы. Металлоорганические каркасы Классификация белков
Классификация белков Химическая термодинамика
Химическая термодинамика Классификация веществ
Классификация веществ Кислород
Кислород Распределение электронов в атомах
Распределение электронов в атомах Валентность (от латинского valentia – сила)
Валентность (от латинского valentia – сила) Презентация на тему Войди в природу другом
Презентация на тему Войди в природу другом  Якісні реакції органічних речовин
Якісні реакції органічних речовин Презентация на тему Химические синонимы
Презентация на тему Химические синонимы  Основные законы химии
Основные законы химии Магний
Магний Коррозия металлов
Коррозия металлов Генетическая связь между классами неорганических веществ
Генетическая связь между классами неорганических веществ ГАЛОГЕНЫ
ГАЛОГЕНЫ Алкины: получение и свойства
Алкины: получение и свойства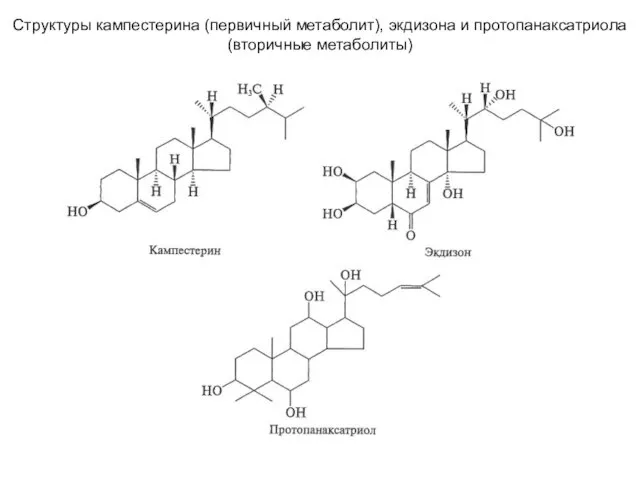 Структуры кампестерина (первичный метаболит), экдизона и протопанаксатриола (вторичные метаболиты)
Структуры кампестерина (первичный метаболит), экдизона и протопанаксатриола (вторичные метаболиты) Методы очистки воды от тяжелых металлов Выполнила: студентка 4 курса 41 группы естественно-географического факультета Кузнецова
Методы очистки воды от тяжелых металлов Выполнила: студентка 4 курса 41 группы естественно-географического факультета Кузнецова