Содержание
- 2. А + В = С + D Условная реакция Чем быстрее происходит процесс изменения концентраций веществ,
- 3. Δn Для того чтобы определить скорость химической реакции нужно знать изменение химического количества ∆n одного из
- 4. Скорость химической реакции — это величина, которая равна отношению изменения молярной концентрации вещества к интервалу времени,
- 5. Гомогенные реакции — это реакции, протекающие в однородной среде, т.е. там, где нет поверхности раздела реагирующих
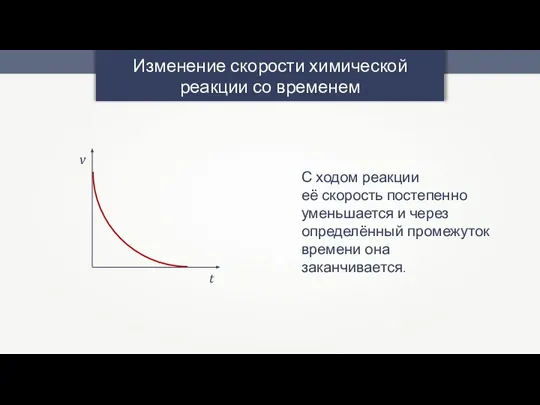
- 6. Изменение скорости химической реакции со временем v t С ходом реакции её скорость постепенно уменьшается и
- 7. Химическая кинетика — раздел химии, который изучает скорость химических реакций.
- 8. Факторы, которые оказывают влияние на скорость химических реакций: – природа реагирующих веществ; – их концентрация; –
- 9. 1. Природа реагирующих веществ HCl Цинк (Zn) Железо (Fe) Медь (Cu)
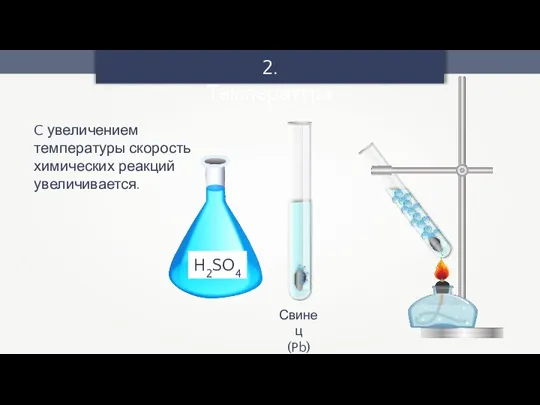
- 10. 2. Температура Свинец (Pb) C увеличением температуры скорость химических реакций увеличивается.
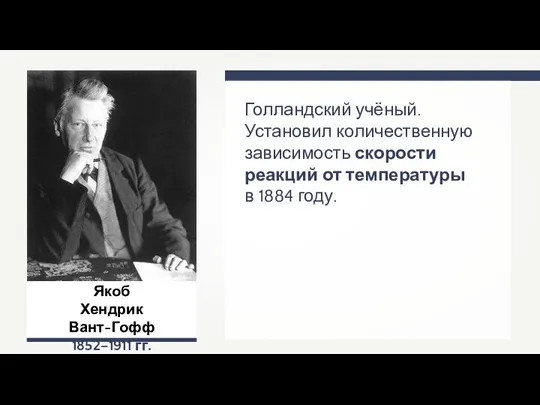
- 11. Якоб Хендрик Вант-Гофф 1852–1911 гг. Голландский учёный. Установил количественную зависимость скорости реакций от температуры в 1884
- 12. Правило Вант-Гоффа: при изменении температуры (повышении либо понижении) на каждые 10°С скорость реакции соответственно изменяется (увеличивается
- 13. γ — температурный коэффициент, который показывает во сколько раз увеличится скорость реакции с повышением температуры на
- 14. 3. Концентрация исходных веществ Чем выше молярные концентрации исходных веществ, тем больше скорость химической реакции.
- 15. К. Гульдберг и П. Вааге Зависимость скорости химической реакции от концентрации реагирующих веществ описана основным законом
- 16. Закон действующих масс: скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных
- 17. Закон действующих масс справедлив только для наиболее простых по своему механизму взаимодействий.
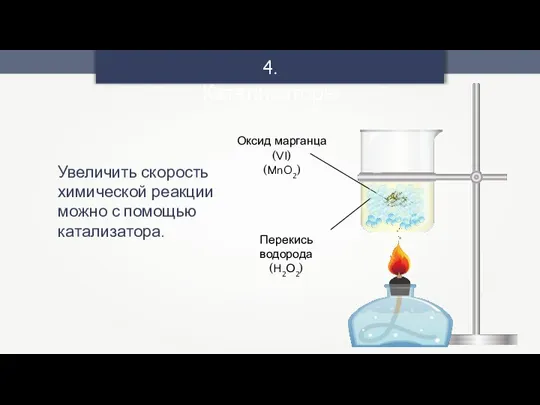
- 18. 4. Катализаторы Увеличить скорость химической реакции можно с помощью катализатора.
- 19. Катализатор — вещество, которое увеличивает скорость химической реакции, но само при этом не расходуется и в
- 20. Катализ — процесс изменения скорости химической реакции добавлением катализатора. Каталитические реакции — реакции с участием катализаторов.
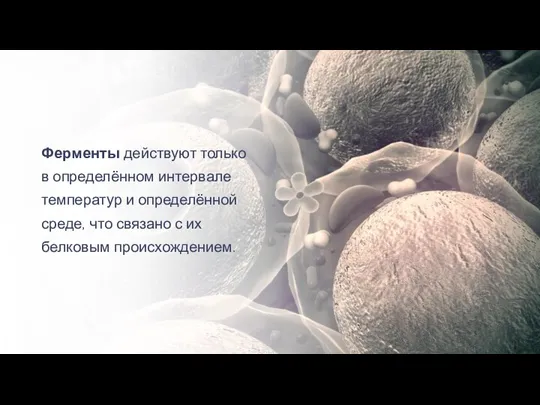
- 21. Ферменты — биологические катализаторы белковой природы.
- 22. Ферменты действуют только в определённом интервале температур и определённой среде, что связано с их белковым происхождением.
- 23. Ингибиторы — вещества, которые служат для уменьшения скорости реакции.
- 25. Скачать презентацию

















 Термостабилизаторы. Доноры водорода
Термостабилизаторы. Доноры водорода Карбоновые кислоты. Сложные эфиры. Жиры
Карбоновые кислоты. Сложные эфиры. Жиры Коллоидные системы
Коллоидные системы Презентация на тему Нитраты и организм человека
Презентация на тему Нитраты и организм человека  Модульная технология на уроках химии
Модульная технология на уроках химии Типы химических реакций. Классификация химических реакций по числу и составу реагентов и продуктов ХР
Типы химических реакций. Классификация химических реакций по числу и составу реагентов и продуктов ХР Пропи́н (метилацетилен, аллилен)
Пропи́н (метилацетилен, аллилен) Сложные вещества кислоты
Сложные вещества кислоты Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Влияние растворителей на скорость органических реакций. (Лекция 10)
Влияние растворителей на скорость органических реакций. (Лекция 10) Презентация на тему Микроэлементы: Хром, Йод, Фтор
Презентация на тему Микроэлементы: Хром, Йод, Фтор  Кальций и его соединения. 9 класс
Кальций и его соединения. 9 класс Закон эквивалентов
Закон эквивалентов Хлордың қолданылуы
Хлордың қолданылуы Электронное строение
Электронное строение Галогены. Межгалогенные соединения
Галогены. Межгалогенные соединения Нуклеиновые кислоты
Нуклеиновые кислоты Основания: номенклатура, классификация, применение, физические свойства
Основания: номенклатура, классификация, применение, физические свойства Алмаз (С)
Алмаз (С) Изготовление искусственного янтаря
Изготовление искусственного янтаря Простые вещества - неметаллы
Простые вещества - неметаллы Дисперсные системы и поверхностные явления
Дисперсные системы и поверхностные явления Коррозия металлов (9 класс)
Коррозия металлов (9 класс) Презентация на тему Классификация полимеров
Презентация на тему Классификация полимеров  Кислотные оксиды, основные оксиды, индикаторы
Кислотные оксиды, основные оксиды, индикаторы Классификация силикатов
Классификация силикатов Атомы. Нахождение в природе
Атомы. Нахождение в природе Презентация по Химии "Алканолы"
Презентация по Химии "Алканолы"