Содержание
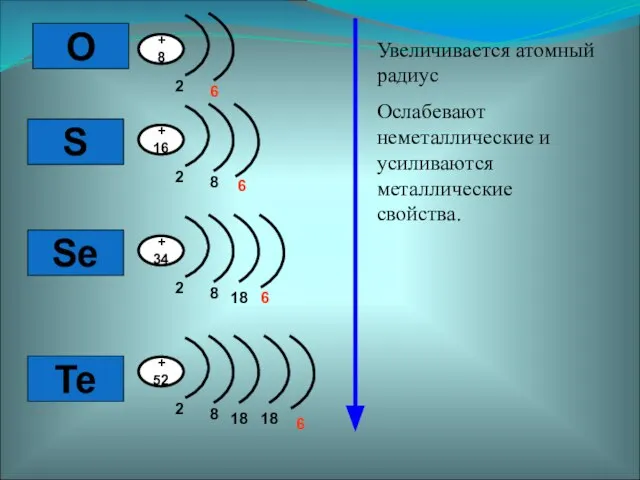
- 2. Элементы VI – А группы Атомы этих элементов содержат на внешнем уровне 6 электронов
- 3. O S Se Te
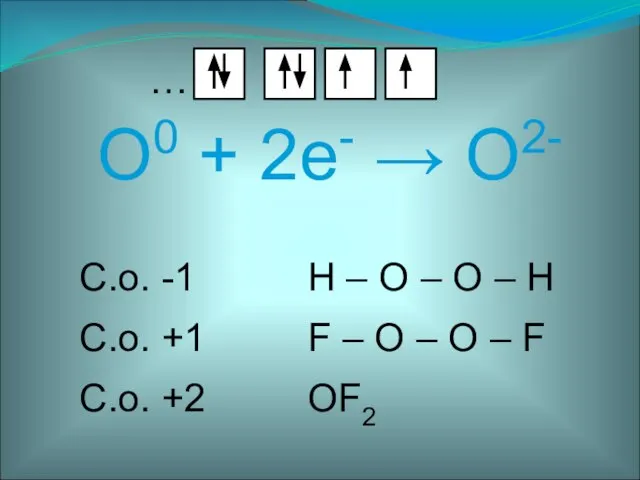
- 4. O0 + 2е- → O2- …
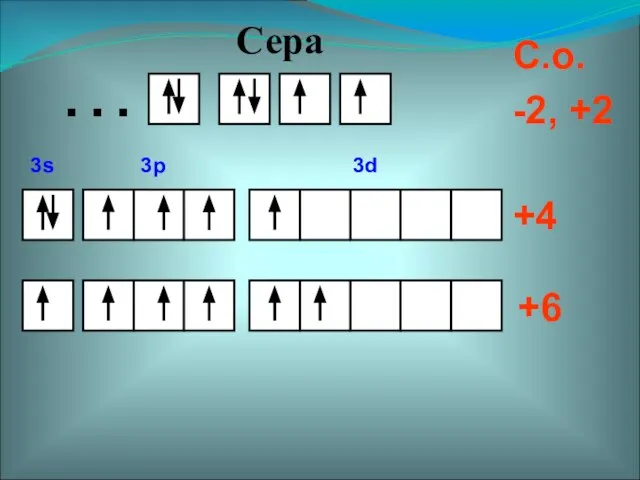
- 5. +4 +6 С.о. -2, +2 … Сера 3s 3p 3d
- 6. Аллотропия кислорода. Кислород и озон
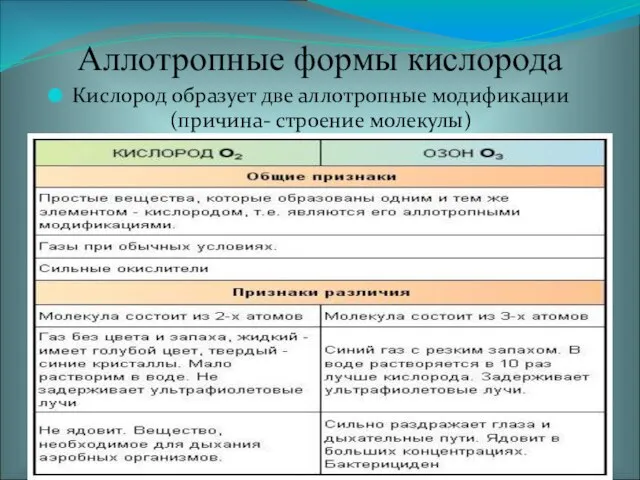
- 7. Аллотропные формы кислорода Кислород образует две аллотропные модификации (причина- строение молекулы)
- 8. Аллотропия серы. Кристаллическая, пластическая и моноклинная http://www.intellect-video.com/4289/27-Poluchenie-plasticheskoy-sery-online/
- 9. Красный железняк (гематит) Fe2O3 «Халькогены» - греч. «рождающие руды» Основные руды – соединения данной подгруппы –
- 10. Магнитный железняк(магнетит) - Fe3O4
- 11. Серный колчедан ( пирит) - FeS2
- 12. Медный колчедан (халькопирит)-CuFeS3
- 13. Цинковая обманка(cфалерит)- ZnS
- 14. Свинцовый блеск (галенит)- PbS
- 15. Киноварь – HgS
- 16. Гипс – CaSO4 *2 H2O
- 17. Глауберова соль (мирабилит)- Na2SO4* 10H2O
- 18. Самородная сера Cелен
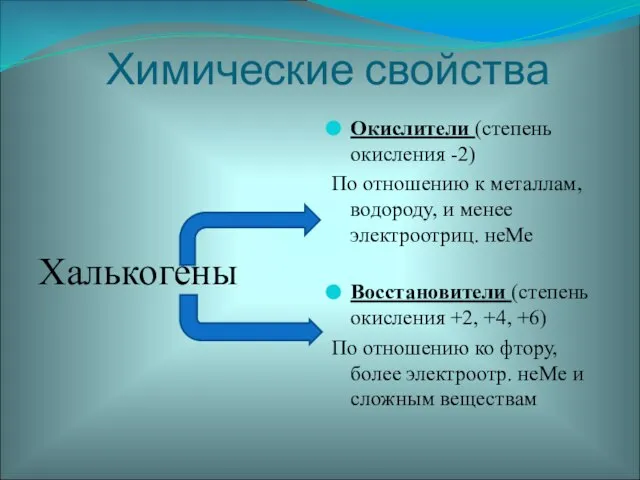
- 19. Химические свойства Халькогены Окислители (степень окисления -2) По отношению к металлам, водороду, и менее электроотриц. неМе
- 20. Химические свойства серы Окислитель Со всеми Ме, кроме Au и Pt А) S + Cu→ http://www.youtube.com/watch?v=quQ9GBdlnxE
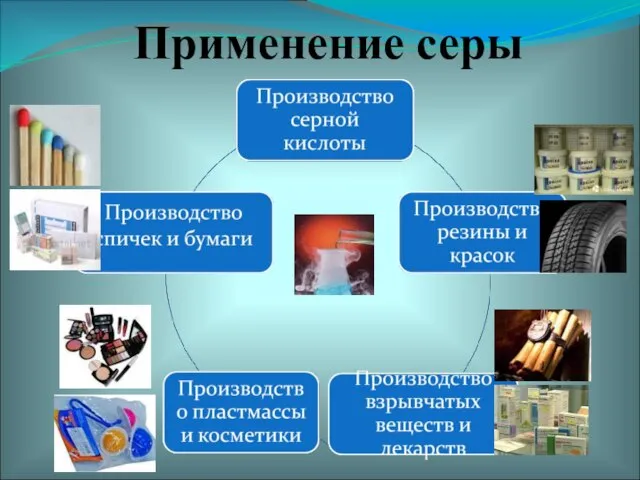
- 21. Применение серы
- 22. Биологическое значение серы Входит в состав белков (белки волос, рогов, шерсти) Составная часть витаминов, ферментов и
- 23. Домашнее задание: § 22, в.1-3. До свидания!
- 25. Скачать презентацию
















 Класс оксиды
Класс оксиды Методы разделения катализаторов и продуктов, используемые для гомогенно-каталитических реакционных систем
Методы разделения катализаторов и продуктов, используемые для гомогенно-каталитических реакционных систем ТЭЦ, работающие на каменном угле более экологичны, чем на буром. Факт или вымысел?
ТЭЦ, работающие на каменном угле более экологичны, чем на буром. Факт или вымысел? Углерод и его свойства
Углерод и его свойства Химия и нанотехнологии
Химия и нанотехнологии Химическая связь. Строение вещества
Химическая связь. Строение вещества Классификация углеводов
Классификация углеводов Mechanika płynów
Mechanika płynów Алхимики в Средние века
Алхимики в Средние века Техника безопасности на уроках химии
Техника безопасности на уроках химии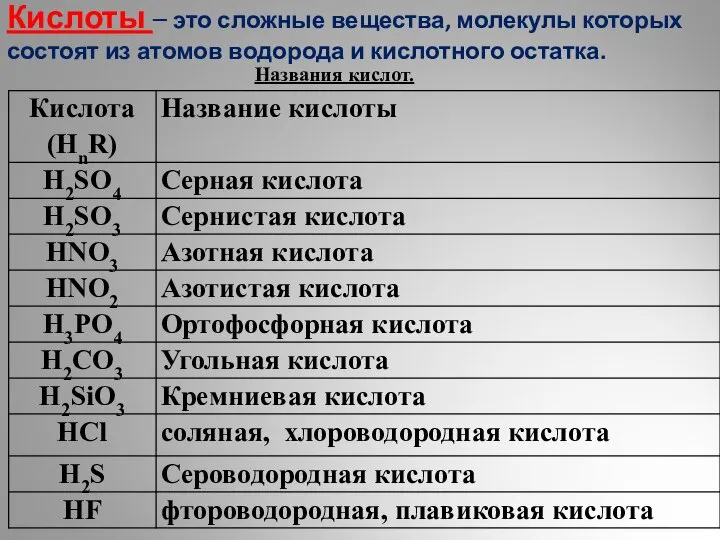 Кислоты. Классификация
Кислоты. Классификация Классификация органических соединений
Классификация органических соединений Физические свойства неметаллов
Физические свойства неметаллов Вывод и обсуждение
Вывод и обсуждение Строение веществ
Строение веществ Поделочный камень родонит
Поделочный камень родонит Материалы в промышленности
Материалы в промышленности Химия элементов (IБ) группы
Химия элементов (IБ) группы Химическая связь
Химическая связь Азотсодержащие гетероциклические соединения пиррол
Азотсодержащие гетероциклические соединения пиррол Гидролиз солей
Гидролиз солей Количественный анализ. Титрование
Количественный анализ. Титрование Поверхность потенциальной энергии и расчет сил, действующих на ионы
Поверхность потенциальной энергии и расчет сил, действующих на ионы Простые вещества – металлы. Физические свойства металлов. Сплавы
Простые вещества – металлы. Физические свойства металлов. Сплавы Определение формул органических веществ. Задачи для самостоятельного решения
Определение формул органических веществ. Задачи для самостоятельного решения Жиры. Определение и общая формула
Жиры. Определение и общая формула Альфа- и бета- распад. Правило смещения
Альфа- и бета- распад. Правило смещения Этапы приготовления и микроскопического исследования нативного препарата осадка мочи
Этапы приготовления и микроскопического исследования нативного препарата осадка мочи