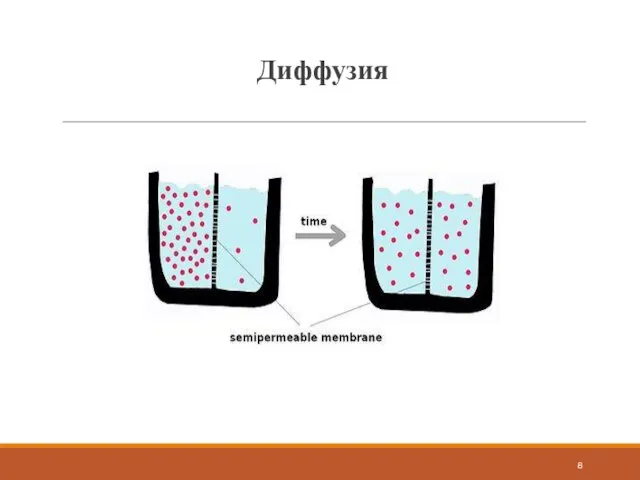
в область с низкой концентрацией.
Все виды диффузии подчиняются общим законам: скорость диффузии пропорциональна площади поперечного сечения образца, а также разности концентраций, температур (или зарядов). Скорость диффузии пропорциональна параметру, характеризующему конкретный материал.
С точки зрения термодинамики движущим потенциалом любого процесса является рост энтропии. При постоянном давлении и температуре таким потециалом является химический потенциал. Поток вещества пропорционален градиенту потенциала.
Диффузия










 Органическая химия. Ароматические углеводороды
Органическая химия. Ароматические углеводороды Генетические ряды Fe2+ и Fе3+. Качественные реакции на Fе2+ и Fе3+
Генетические ряды Fe2+ и Fе3+. Качественные реакции на Fе2+ и Fе3+ Типы кристаллических структур Автор Могилевская А.Е. Санкт-Петербург. ГБОУ СОШ№535
Типы кристаллических структур Автор Могилевская А.Е. Санкт-Петербург. ГБОУ СОШ№535 Термореактивные пластмассы (реактопласты)
Термореактивные пластмассы (реактопласты) Полистирол. Оформление мини-реферата по химии
Полистирол. Оформление мини-реферата по химии Химические реакции в органической химии
Химические реакции в органической химии Фенол. Понятие о фенолах
Фенол. Понятие о фенолах Азот. Физические свойства азота
Азот. Физические свойства азота Использование ИКТ в преподавании химии
Использование ИКТ в преподавании химии Химико-металлургические методы
Химико-металлургические методы Презентация на тему Бинарные соединения
Презентация на тему Бинарные соединения  Неметаллы в природе и жизни человека
Неметаллы в природе и жизни человека Содержание варианта ЕГЭ
Содержание варианта ЕГЭ Вирощування кристалів солей
Вирощування кристалів солей Молекулярная струйная печать
Молекулярная струйная печать Производство уранового топлива. Обогащение урана
Производство уранового топлива. Обогащение урана АРЕНЫ
АРЕНЫ Окисники, відновники
Окисники, відновники Разветвленные цепные реакции
Разветвленные цепные реакции Валентность
Валентность Железо как химический элемент
Железо как химический элемент Презентация на тему Стекло. История открытия, получение, применение
Презентация на тему Стекло. История открытия, получение, применение  10-4 (2)
10-4 (2) Магматические породы
Магматические породы Химические свойства оксидов
Химические свойства оксидов Технология получения красного фосфора
Технология получения красного фосфора Презентация по Химии "Металлы в организме человека"
Презентация по Химии "Металлы в организме человека"  Звездный час. Знатоки химии
Звездный час. Знатоки химии