Содержание
- 3. Радикалы, содержащие двойную связь, также носят тривиальные названия: Формула радикала Тривиальное название CH2=CH- винил CH2=CH-CH2— аллил
- 6. Запомните! Цис-транс-изомерия не характерна для тех алкенов, у которых хотя бы один из атомов углерода при
- 7. Способы получения алкенов Дегидрирование алканов При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в
- 8. Крекинг – это реакция разложения алкана с длинной углеродной цепью на алканы и алкены с более
- 9. Дегидрогалогенирование галогеналканов Галогеналканы взаимодействуют с щелочами в спиртовом растворе. При этом происходит дегидрогалогенирование – отщепление (элиминирование)
- 10. Дегидратация спиртов При нагревании спиртов (выше 140оС) в присутствии водоотнимающих веществ (концентрированная серная кислота, фосфорная кислота)
- 11. Дегалогенирование дигалогеналканов Дигалогеналканы, в молекулах которых два атома галогена расположены у соседних атомов углерода, реагируют с
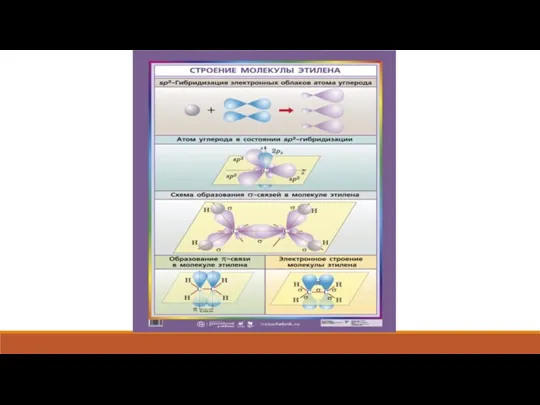
- 12. Химические свойства Для алкенов характерны реакции присоединения по двойной связи С=С, при которых протекает разрыв пи-связи
- 13. 2. Галогенирование алкенов Присоединение галогенов к алкенам происходит даже при комнатной температуре в растворе (растворители —
- 14. Окисление алкенов 1. Каталитическое окисление. Каталитическое окисление протекает под действием катализатора. Взаимодействие этилена с кислородом в
- 15. 2. Мягкое окисление Мягкое окисление протекает при низкой температуре в присутствии перманганата калия. При этом раствор
- 16. 3. Жесткое окисление При жестком окислении под действием перманганатов или соединений хрома (VI) происходит полный разрыв
- 18. Скачать презентацию














 Metalai. Metalų apibūdinimas
Metalai. Metalų apibūdinimas Химическое равновесие
Химическое равновесие Строение и свойства алканов
Строение и свойства алканов Строение атома. Планетарная модель атома Резерфорда
Строение атома. Планетарная модель атома Резерфорда Железо
Железо Свойства алкенов
Свойства алкенов Типичные экспериментальные кинетические данные
Типичные экспериментальные кинетические данные Химический канцерогенез
Химический канцерогенез Лёгкие металлы
Лёгкие металлы Генетическая связь между классами неорганических веществ
Генетическая связь между классами неорганических веществ Основи молекулярно-кінетичної теорії
Основи молекулярно-кінетичної теорії Первоначальные химические понятия
Первоначальные химические понятия Гидроксиды металлов
Гидроксиды металлов Формирование УУД и познавательных приемов на уроках химии
Формирование УУД и познавательных приемов на уроках химии Химия и автомобиль
Химия и автомобиль Вода. Физические свойства воды
Вода. Физические свойства воды Растворы. Квалификации химических веществ:
Растворы. Квалификации химических веществ: Строение атома
Строение атома Классификация реакций и реагентов. Кислотные и основные свойства биомолекул
Классификация реакций и реагентов. Кислотные и основные свойства биомолекул Соединения железа
Соединения железа Презентация на тему Ионные уравнения реакций (8 класс)
Презентация на тему Ионные уравнения реакций (8 класс)  Биопластик на основе лигнина
Биопластик на основе лигнина Гипер-гипофосфатемия
Гипер-гипофосфатемия Розчинність речовин, її залежність від різних чинників
Розчинність речовин, її залежність від різних чинників Теория электролитической диссоциации
Теория электролитической диссоциации Кислоты
Кислоты Уретановый каучук
Уретановый каучук Основания: определение, классификация, химические свойства
Основания: определение, классификация, химические свойства