Содержание
- 2. ПРОВЕРКА РАННЕЕ ИЗУЧЕННОГО 1. Куда сместится равновесие при понижении температуры. 2. При повышении давления. 3. При
- 3. Фарадей Майкл 22. IX.1791 – 25.VIII. 1867 Английский физик и химик. В первой половине 19 в.
- 4. ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ (ТЭД) В 1887 году шведский учёный С. Аррениус для объяснения особенностей водных растворов
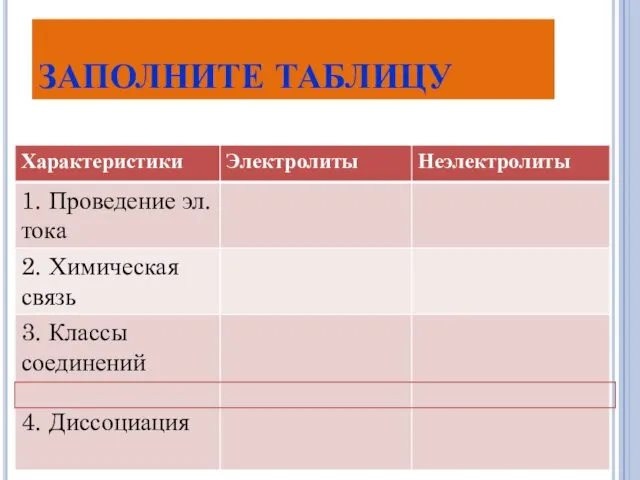
- 5. ЗАПОЛНИТЕ ТАБЛИЦУ
- 6. Вещества Электролиты – Неэлектролиты – проводят эл.ток в растворах не проводят эл. ток в растворах Тип
- 7. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ 1 ПОЛОЖЕНИЕ Все вещества по их способности проводить электрический ток в растворах делятся на
- 8. Процесс распада электролита на ионы называется электролитической диссоциацией. Химический словарь
- 9. 2 ПОЛОЖЕНИЕ При растворении в воде электролиты диссоциируют (распадаются) на положительные и отрицательные ионы Ионы –
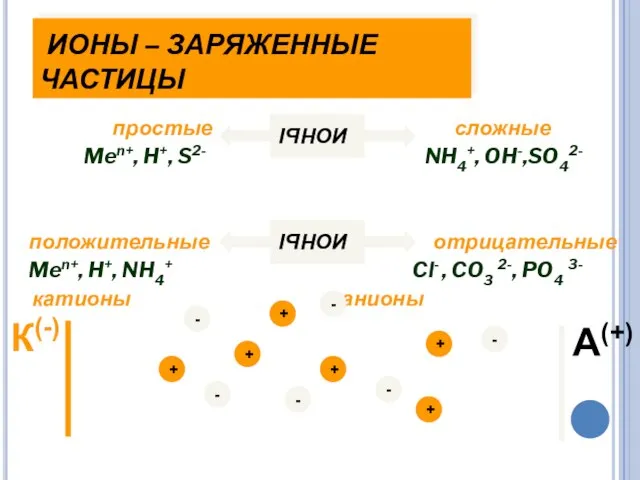
- 10. ИОНЫ - это положительно или отрицательно заряженные частицы, в которые превращаются атомы или группы атомов в
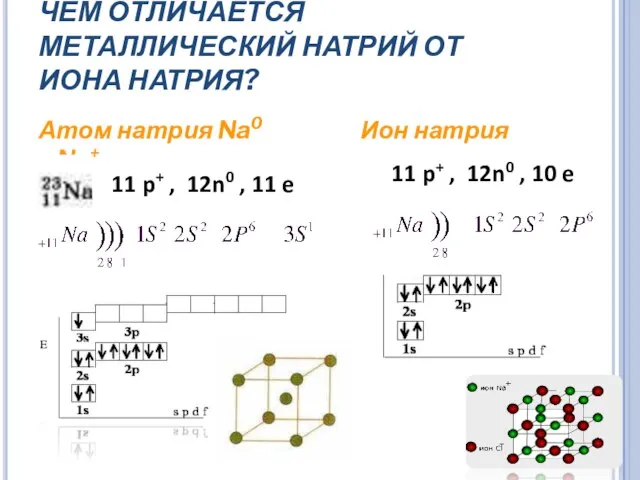
- 11. ЧЕМ ОТЛИЧАЕТСЯ МЕТАЛЛИЧЕСКИЙ НАТРИЙ ОТ ИОНА НАТРИЯ? Атом натрия Na0 Ион натрия Na+ 11 p+ ,
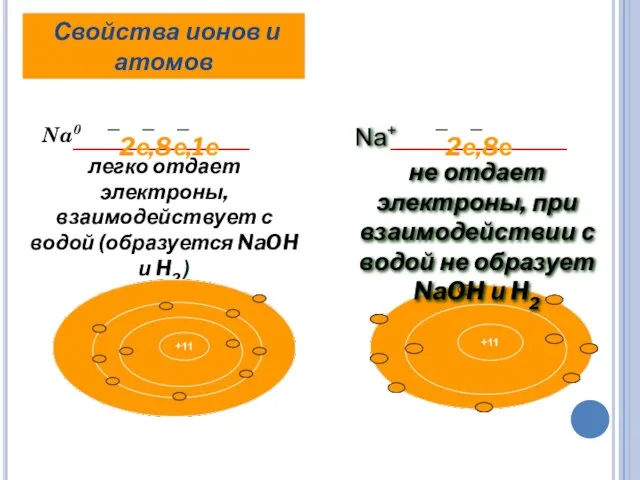
- 12. Na0 легко отдает электроны, взаимодействует с водой (образуется NaOH и H2 ) Свойства ионов и атомов
- 13. ИОНЫ – ЗАРЯЖЕННЫЕ ЧАСТИЦЫ простые сложные Men+, H+, S2- NH4+, OH-,SO42- положительные отрицательные Men+, H+, NH4+
- 14. 3 ПОЛОЖЕНИЕ Причиной диссоциации электролита является его взаимодействие с молекулами воды и разрыв химической связи в
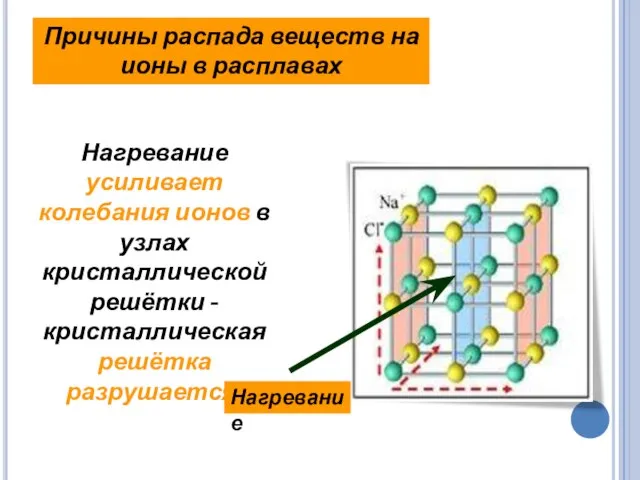
- 15. Нагревание усиливает колебания ионов в узлах кристаллической решётки -кристаллическая решётка разрушается. Причины распада веществ на ионы
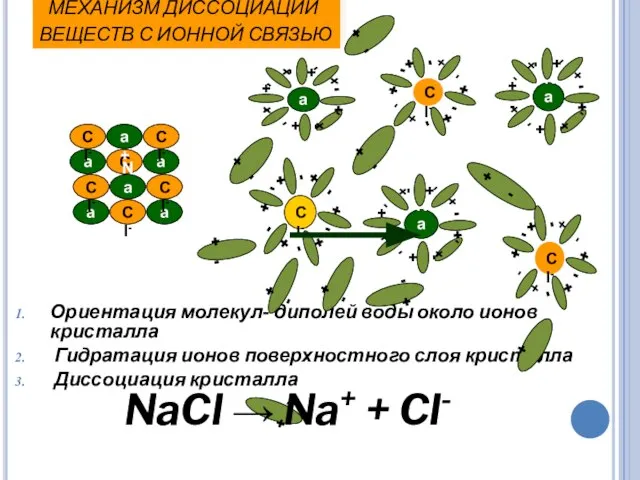
- 16. МЕХАНИЗМ ДИССОЦИАЦИИ ВЕЩЕСТВ С ИОННОЙ СВЯЗЬЮ Ориентация молекул- диполей воды около ионов кристалла Гидратация ионов поверхностного
- 17. СУЩНОСТЬ ПРОЦЕССА ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ ВЕЩЕСТВ С КОВАЛЕНТНОЙ ПОЛЯРНОЙ СВЯЗЬЮ ориентация молекул воды вокруг полюсов молекулы электролита
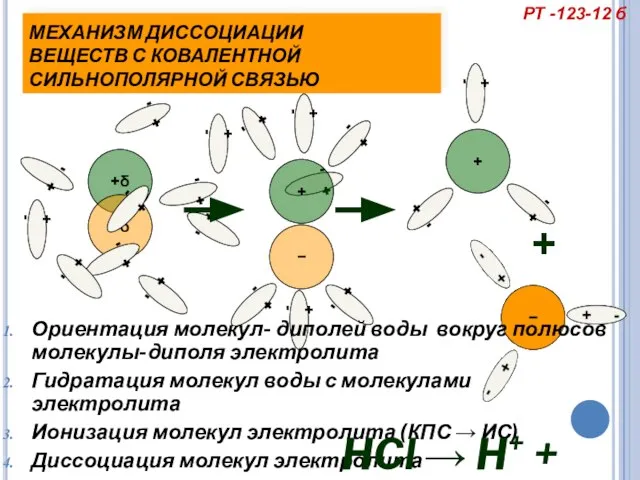
- 18. + - + - + - + - МЕХАНИЗМ ДИССОЦИАЦИИ ВЕЩЕСТВ С КОВАЛЕНТНОЙ СИЛЬНОПОЛЯРНОЙ СВЯЗЬЮ Ориентация
- 20. Скачать презентацию










 Игра Кто хочет стать отличником? (за курс органической химии)
Игра Кто хочет стать отличником? (за курс органической химии) Биологически важные реакции монофункциональных соединений. Реакционная способность спиртов, фенолов, тиолов, аминов
Биологически важные реакции монофункциональных соединений. Реакционная способность спиртов, фенолов, тиолов, аминов Бромистый этил
Бромистый этил Соли. Свойства. Получение
Соли. Свойства. Получение ПОЛОЖЕНИЕ ВОДОРОДА В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ
ПОЛОЖЕНИЕ ВОДОРОДА В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ Железо и его соединения. Строение атома железа
Железо и его соединения. Строение атома железа Металлы и их соединения
Металлы и их соединения Кремневые породы
Кремневые породы Сульфиты. Сульфаты. Кислотные дожди
Сульфиты. Сульфаты. Кислотные дожди Брожения
Брожения Презентация по Химии "Ковалентная химическая связь"
Презентация по Химии "Ковалентная химическая связь"  Водород
Водород Обобщение и повторение за курс основной школы по химии. 9 класс
Обобщение и повторение за курс основной школы по химии. 9 класс Кислород
Кислород Понятие о химической реакции. Реакции, идущие без изменения состава веществ. 11 класс
Понятие о химической реакции. Реакции, идущие без изменения состава веществ. 11 класс Биосинтез гема
Биосинтез гема Соли: классификация, получение, номенклатура
Соли: классификация, получение, номенклатура 10_Valentnost_khimicheskikh_elementov
10_Valentnost_khimicheskikh_elementov Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях
Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях Композитные материалы
Композитные материалы Презентация на тему Фенол и его свойства
Презентация на тему Фенол и его свойства  Фосфорорганические соединения
Фосфорорганические соединения Подготовка к контрольной работе. 8 класс
Подготовка к контрольной работе. 8 класс Генетические ряды металлов и неметаллов
Генетические ряды металлов и неметаллов Строение вещества. Эксперименты
Строение вещества. Эксперименты Ионные равновесия в растворах
Ионные равновесия в растворах Аминокислоты. Викторина
Аминокислоты. Викторина Абсорбционная осушка газа
Абсорбционная осушка газа