Содержание
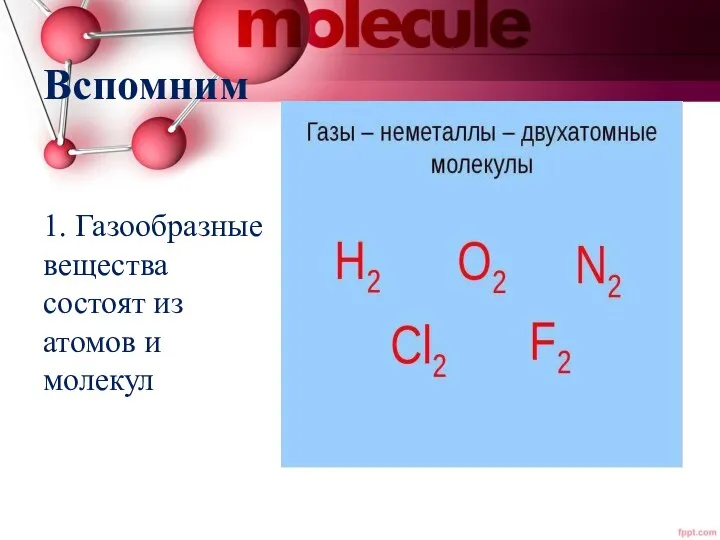
- 2. Вспомним 1. Газообразные вещества состоят из атомов и молекул
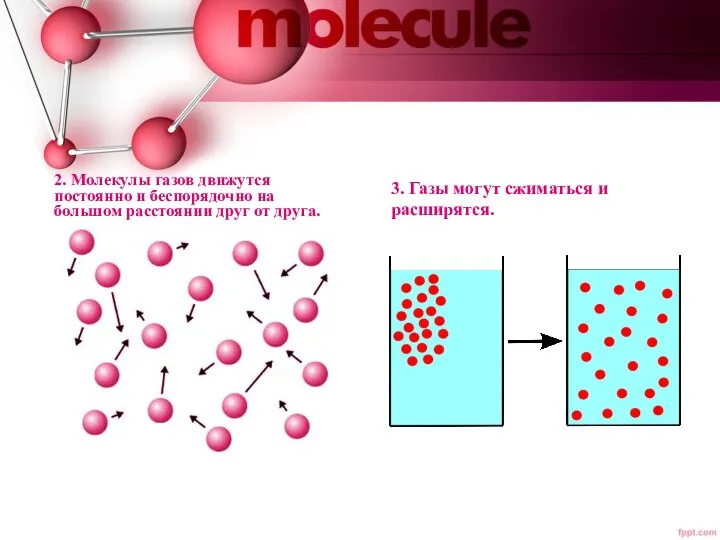
- 3. 2. Молекулы газов движутся постоянно и беспорядочно на большом расстоянии друг от друга. 3. Газы могут
- 4. 4. В газообразном состоянии вещества не имеют форму. Они приобретают форму сосуда, в котором находятся. 1
- 5. Газы подчиняются определённым законам Исходя из данных полученных в результате экспериментов и на основе законов Бойля
- 6. На основе этих законов и своих наблюдений Амедео Авогадро в 1811 г. высказал гипотезу, которая впоследствии
- 7. Следствие закона Авогадро Определенное число молекул будет всегда занимать строго определенный объём при одинаковых давлении и
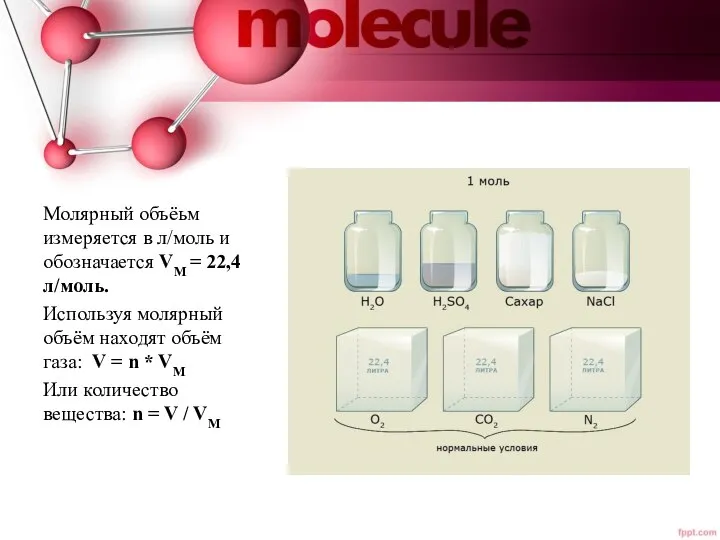
- 8. Молярный объёьм измеряется в л/моль и обозначается VM = 22,4л/моль. Используя молярный объём находят объём газа:
- 9. Задача 1. Какой объём при н.у. занимает 2 моля метана. Решение: V(CH4) = n(CH4) /V м
- 10. Задача 2. Вычислите, сколько молекул содержится в 0,5 л газообразного водорода Решение: N(Н2) = n (H2)*NA
- 12. Скачать презентацию






 Великий кислород
Великий кислород Фенол. Физические свойства
Фенол. Физические свойства Мемо-химия. Защита проекта
Мемо-химия. Защита проекта Периодический закон. Периодическая таблица химических элементов. 8 класс
Периодический закон. Периодическая таблица химических элементов. 8 класс Классификация органических соединений
Классификация органических соединений Основы переработки нефти и нефтепродуктов
Основы переработки нефти и нефтепродуктов Неорганические вещества
Неорганические вещества Электролиз
Электролиз Ковалентная связь. Электроотрицательность
Ковалентная связь. Электроотрицательность Презентация на тему Предельные одноатомные спирты
Презентация на тему Предельные одноатомные спирты  Презентация на тему Водород (8 класс)
Презентация на тему Водород (8 класс)  Химиялық фармацевтикалық техниканың үдерістері
Химиялық фармацевтикалық техниканың үдерістері Термодинамическое равновесие между фазами
Термодинамическое равновесие между фазами Полимеры в медицине
Полимеры в медицине Основы химической термодинамики
Основы химической термодинамики Железо как химический элемент
Железо как химический элемент Простые эфиры и перекиси
Простые эфиры и перекиси Витамины. Способы получения
Витамины. Способы получения Химическая кинетика. Экзаменационные вопросы
Химическая кинетика. Экзаменационные вопросы Хроматометрия. Метод
Хроматометрия. Метод Основания. 8 класс
Основания. 8 класс Ароматические углеводороды. Бензол
Ароматические углеводороды. Бензол Периодическая система химических элементов. Им. Д.И. Менделеева
Периодическая система химических элементов. Им. Д.И. Менделеева Повторение классов соединений. Составление формул по названиям
Повторение классов соединений. Составление формул по названиям Исследование физико-химических свойств растворов сахарозы
Исследование физико-химических свойств растворов сахарозы Окислительно=восстановительное титрование
Окислительно=восстановительное титрование Изучение возможности синтеза порошка сложного карбонитрида -титана молибдена Ti-Mo в режиме СВС
Изучение возможности синтеза порошка сложного карбонитрида -титана молибдена Ti-Mo в режиме СВС Кислород
Кислород