Содержание
- 2. 1807г. Томас Юнг: «энергия ≡ внутренняя работа», Юлиус Майер и Джеймс Прескот Джоуль: теплота работа 1840г.
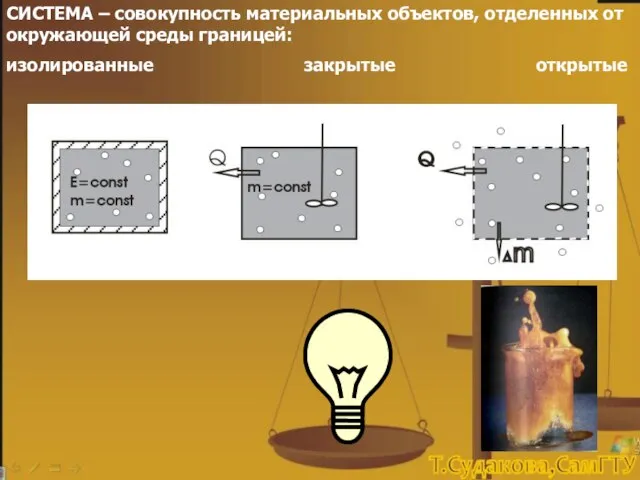
- 3. СИСТЕМА – совокупность материальных объектов, отделенных от окружающей среды границей: изолированные закрытые открытые
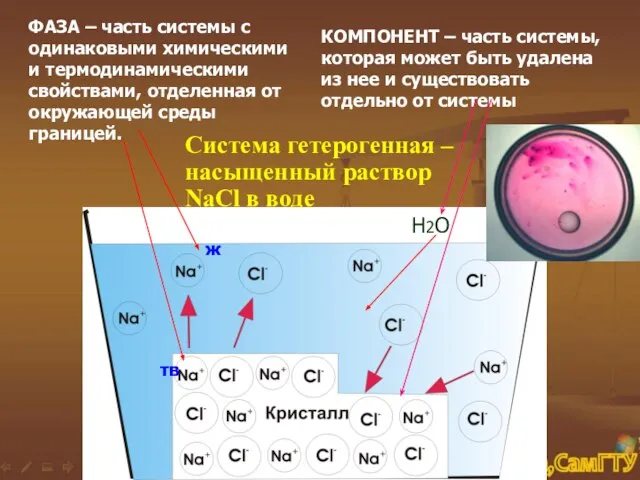
- 4. ФАЗА – часть системы с одинаковыми химическими и термодинамическими свойствами, отделенная от окружающей среды границей. КОМПОНЕНТ
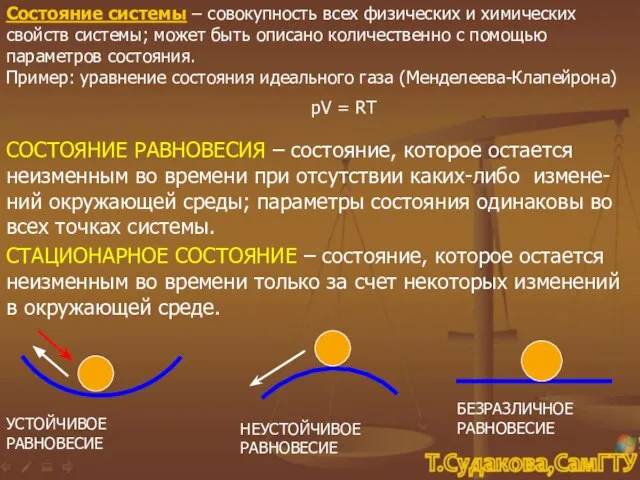
- 5. Состояние системы – совокупность всех физических и химических свойств системы; может быть описано количественно с помощью
- 6. I закон термодинамики Q = ΔU + А: в общем случае поступившая в систему извне тепловая
- 7. Внутренняя энергия – энергия химических связей внутри молекул, энергия межмолекулярного взаимодействия, кинетическая энергия поступательного, колебательного и
- 8. Для Р = const (изобарный процесс) : ΔU = U2 -U1 = QP - А =
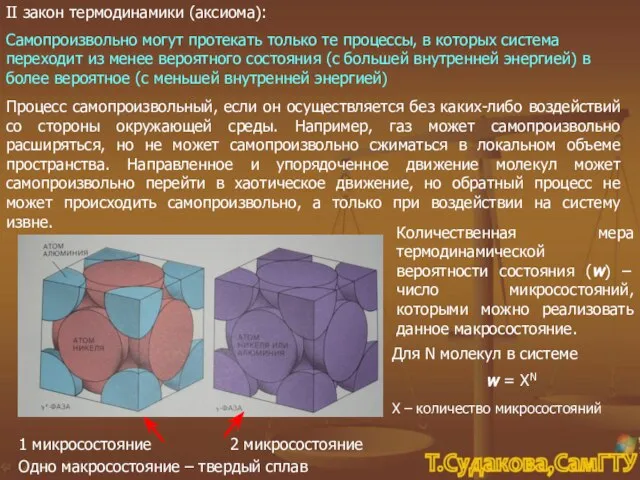
- 9. II закон термодинамики (аксиома): Самопроизвольно могут протекать только те процессы, в которых система переходит из менее
- 10. Л. Больцман (1844 – 1906) ln (w) = ln (XN) Х≡S = k • ln w,
- 11. Энтропия как мера неупорядоченности в системе. Увеличение энтропии связано с усилением хаотического движения молекул, атомов и
- 12. Стандартная энтропия образования вещества S0 (Дж/(моль•К) )–изменение энтропии в реакции образования 1 моль сложного вещества из
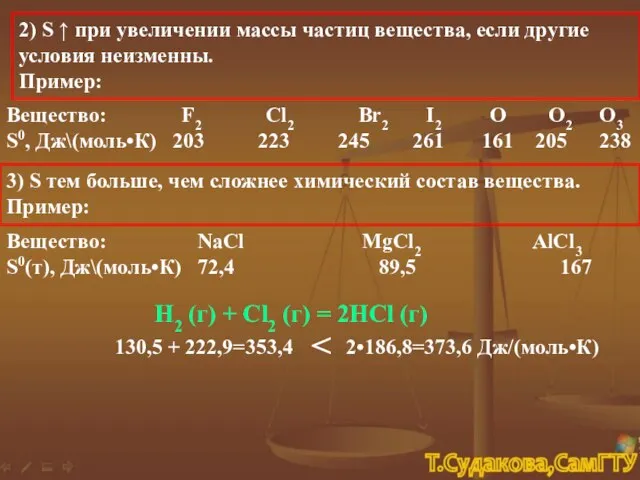
- 13. 2) S ↑ при увеличении массы частиц вещества, если другие условия неизменны. Пример: Вещество: F2 Cl2
- 14. Вещество: СН3ОН(ж) NaCl(т) S0(т, ж), Дж\(моль•К) 127,0 72,4 S0(р-р в воде), Дж\(моль•К) 132,3 115,4 4) S
- 15. 6) S ↓ при растворении газов в жидком растворителе. Вещество: СН3ОН (г) HCl (г) S0(г), Дж\(моль•К)
- 16. Д.У. Гиббс (1839 – 1903) ОТКРЫТЫЕ СИСТЕМЫ (биологические, живые организмы): Δ S ПРОТИВОРЕЧИЕ II закону? Свободная
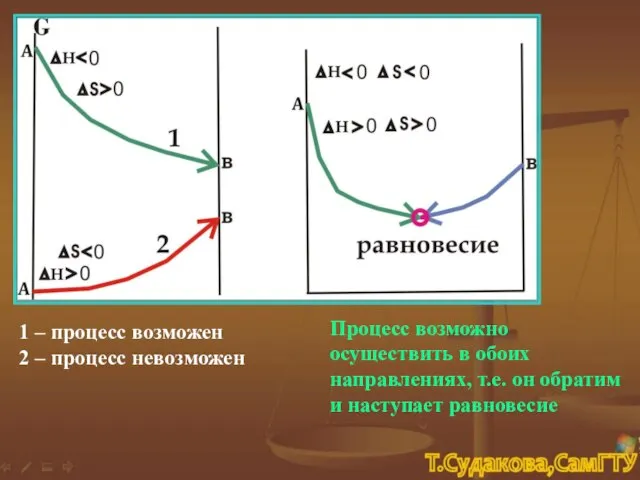
- 17. При Т=const и Р=const химические реакции могут протекать самопроизвольно только в направлении, при котором G системы
- 18. 1 – процесс возможен 2 – процесс невозможен Процесс возможно осуществить в обоих направлениях, т.е. он
- 19. СВЯЗЬ ЭНЕРГИИ ГИББСА С КОНСТАНТОЙ РАВНОВЕСИЯ РЕАКЦИИ ТЕРМОДИНАМИЧЕСКОЕ РАВНОВЕСИЕ ДЛЯ ХИМИЧЕСКОЙ РЕАГИРУЮЩЕЙ СИСТЕМЫ ХАРАКТЕРИЗУЕТСЯ ОТСУТСТВИЕМ ВЫДЕЛЕНИЯ
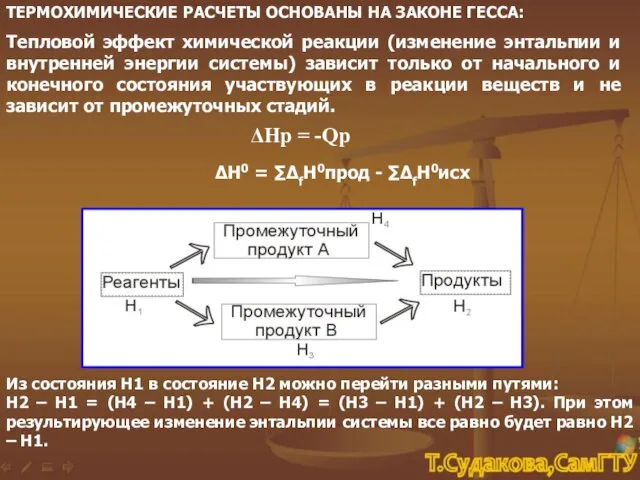
- 20. ТЕРМОХИМИЧЕСКИЕ РАСЧЕТЫ ОСНОВАНЫ НА ЗАКОНЕ ГЕССА: Тепловой эффект химической реакции (изменение энтальпии и внутренней энергии системы)
- 21. С + О2 = СO2 + Q1 = -Δ Н1 С+ 1/2О2=СО+Q2 = -ΔН2 СО+ 1/2
- 22. Термохимические уравнения сгорания: (1) С (графит) + О2 (г) → СО2 (г) ΔН0 = - 394,1
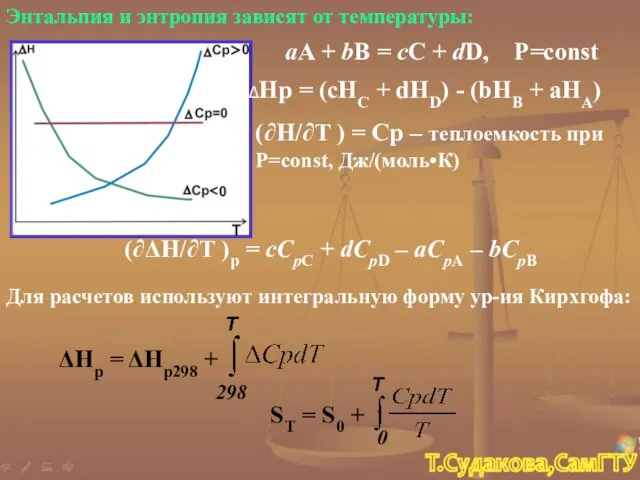
- 23. Энтальпия и энтропия зависят от температуры: aA + bB = cC + dD, P=const ΔHp =
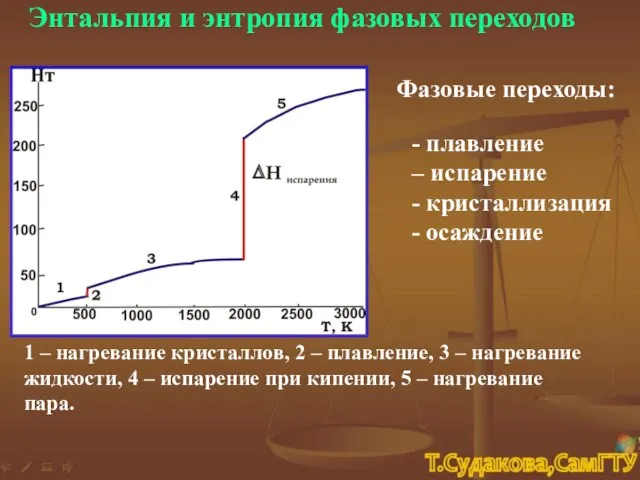
- 24. Энтальпия и энтропия фазовых переходов Фазовые переходы: - плавление – испарение - кристаллизация - осаждение 1
- 26. Скачать презентацию














 Химическая связь. Урок-упражнение
Химическая связь. Урок-упражнение Геохимические процессы в литосфере Земли и геобаротермометрия
Геохимические процессы в литосфере Земли и геобаротермометрия Решение задач
Решение задач Prezentatsia_lektsia_Reaktora_1_Klassifikatsia
Prezentatsia_lektsia_Reaktora_1_Klassifikatsia Соли как производные кислот и оснований
Соли как производные кислот и оснований Л1.4. Диаграмма железо-углерод
Л1.4. Диаграмма железо-углерод Алкены Бутен
Алкены Бутен ЛКМ на основе кремнийорганических соединений
ЛКМ на основе кремнийорганических соединений Химические методы анализа. Аналитические методы контроля в техносферной безопасности. Лекция 6
Химические методы анализа. Аналитические методы контроля в техносферной безопасности. Лекция 6 Разминка
Разминка Простые вещества - неметаллы
Простые вещества - неметаллы Презентация на тему Электролиты
Презентация на тему Электролиты  Полимеры
Полимеры Получение функциональных плёнок на основе TiO2
Получение функциональных плёнок на основе TiO2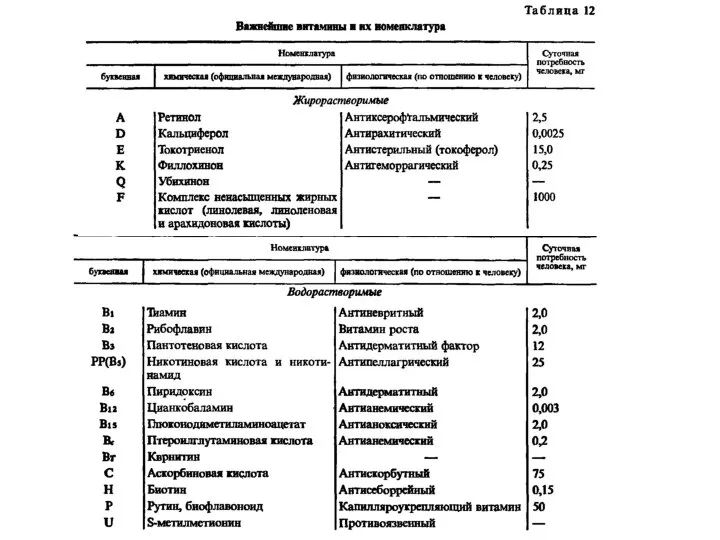 Важнейшие витамины и их номенклатура
Важнейшие витамины и их номенклатура Лекция 26. Химическое (водородное) и электрохимическое аккумулирование энергии
Лекция 26. Химическое (водородное) и электрохимическое аккумулирование энергии Лавка возможностей
Лавка возможностей Количество вещества
Количество вещества Строение атома
Строение атома Гидролиз солей
Гидролиз солей Органика из аптеки
Органика из аптеки Кислоты: состав, классификация, номенклатура, получение
Кислоты: состав, классификация, номенклатура, получение Обратимость химических реакций. Химическое равновесие
Обратимость химических реакций. Химическое равновесие Исследование биодеградации полимерных материалов методом АСМ
Исследование биодеградации полимерных материалов методом АСМ Химические уравнения
Химические уравнения Строение вещества. Виды химической связи
Строение вещества. Виды химической связи Интерактивная интеллектуальная игра Юный химик
Интерактивная интеллектуальная игра Юный химик Примеры реакций в жизни и в быту. Реакции по направлению процесса
Примеры реакций в жизни и в быту. Реакции по направлению процесса