Содержание
- 2. Установите соответствие между формулой вещества и видом химической связи 1.Задание на соответствие Формула вещества Вид химической
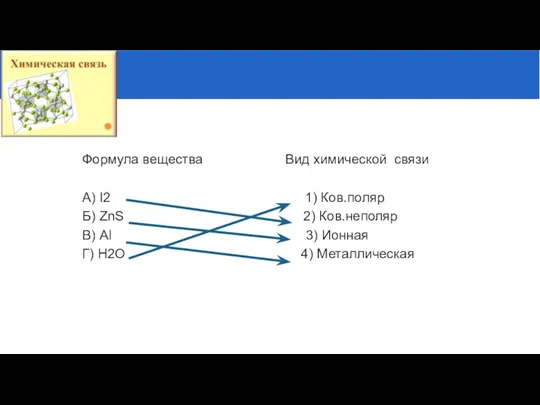
- 3. Установите соответствие между формулой вещества и видом химической связи Формула вещества Вид химической связи А) I2
- 4. 2. Выберите группу веществ, в состав которой входят только вещества с ионной связью связью: Nа, К,
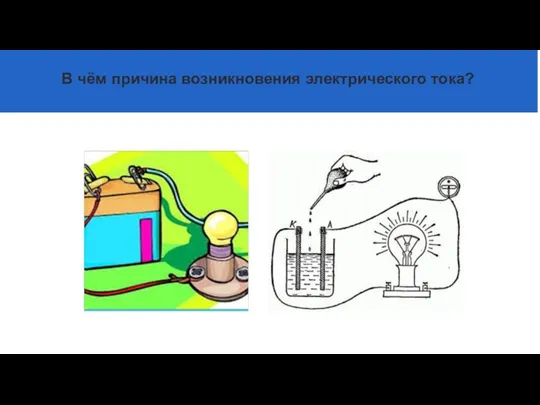
- 5. В чём причина возникновения электрического тока?
- 6. Растворы всех веществ можно разделить на две группы: проводят электрический ток или проводниками не являются.
- 7. Электролиты все растворимые соли щёлочи растворимые кислоты Неэлектролиты нерастворимые соли, кислоты, основания оксиды вещества с ковалентной
- 8. Электролиты NaCl (раствор) NaOH(раствор) Н2SO4 (раствор) СuSO4 (раствор) CH3COOH (раствор; столовый уксус 9%) Неэлектролиты Н2О (прот.)
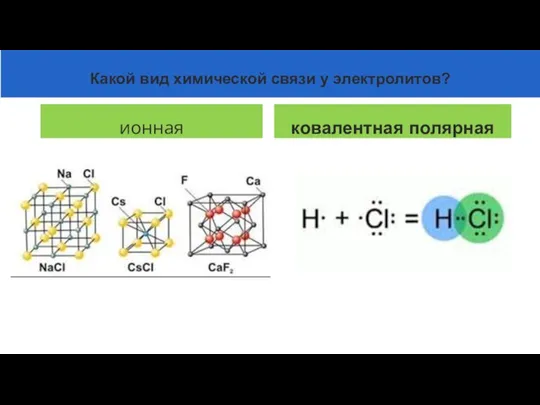
- 9. ионная ковалентная полярная Какой вид химической связи у электролитов?
- 10. Для объяснения особенностей водных растворов электролитов шведским ученым С. Аррениусом в 1887 г. была предложена теория
- 11. Электролиты при растворении в воде или расплавлении распадаются (диссоциируют) на ионы – положительно (катионы) и отрицательно
- 12. Ионы находятся в более устойчивых электронных состояниях, чем атомы. Они могут состоять из одного атома -
- 13. В растворах и расплавах электролиты проводят электрический ток. Под действием электрического тока ионы приобретают направленное движение.
- 14. Движение ионов к электродам Положительно заряженные ионы движутся к катоду, отрицательно заряженные - к аноду. Поэтому
- 15. Диссоциация - обратимый процесс: параллельно с распадом молекул на ионы (диссоциация) протекает процесс соединения ионов (ассоциация).
- 16. 1. Какие вещества называются электролитами? Приведите примеры. 2. Почему эти вещества проводят электрический ток? 3. Какие
- 18. Скачать презентацию












 Осуществление цепочки химических превращений. Практическая работа №1
Осуществление цепочки химических превращений. Практическая работа №1 Щелочные металлы
Щелочные металлы Стирол - важнейшее производное бензола
Стирол - важнейшее производное бензола Методы пробоотбора и пробоподготовки донных отложений, почв и грунтов
Методы пробоотбора и пробоподготовки донных отложений, почв и грунтов Интересное о кристаллизации
Интересное о кристаллизации Ковалентная полярная химическая связь
Ковалентная полярная химическая связь Нефть - черное золото
Нефть - черное золото Мышьяк. История. Нахождение в природе
Мышьяк. История. Нахождение в природе Свойства воды в твердом и жидком состоянии
Свойства воды в твердом и жидком состоянии Классы неорганических соединений
Классы неорганических соединений Общие представления об электрохимических технологиях
Общие представления об электрохимических технологиях АТФ и другие органические соединения клетки
АТФ и другие органические соединения клетки Комплексное задание по дисциплине основы материаловедения для группы 18
Комплексное задание по дисциплине основы материаловедения для группы 18 Скорость химических реакций
Скорость химических реакций Изготовление искусственного янтаря
Изготовление искусственного янтаря Металлы. Кроссворд
Металлы. Кроссворд Основные химические понятия и законы химии. (Часть 1)
Основные химические понятия и законы химии. (Часть 1) Металлы и неметаллы. Знакомство с периодической системой Д. И. Менделеева
Металлы и неметаллы. Знакомство с периодической системой Д. И. Менделеева Альфа и бета распад. Правило смещения
Альфа и бета распад. Правило смещения Основные понятия химии
Основные понятия химии Амины
Амины Биологические буферные системы
Биологические буферные системы Презентация на тему Ковалентная связь: полярная и неполярная
Презентация на тему Ковалентная связь: полярная и неполярная  Презентация на тему Алюминий как химический элемент и как простое вещество
Презентация на тему Алюминий как химический элемент и как простое вещество  Бензол (Арены )
Бензол (Арены ) Примеры карбоновых кислот
Примеры карбоновых кислот Получение бутандиола, как способ переработки природного газа
Получение бутандиола, как способ переработки природного газа Тематическая викторина Химические элементы, металлы и неметаллы
Тематическая викторина Химические элементы, металлы и неметаллы