Содержание
- 2. Цель: рассмотреть строение алканов на примере метана, сформировать представление о номенклатуре, видах изомерии и свойствах алканов.
- 3. Общая формула Алканы – углеводороды, в молекулах которых атомы связаны одинарными связями и соответствующие общей формуле
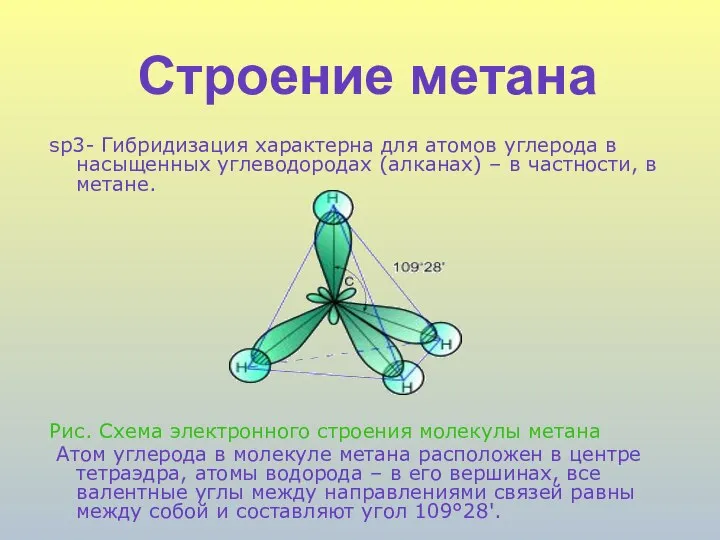
- 4. Строение метана sp3- Гибридизация характерна для атомов углерода в насыщенных углеводородах (алканах) – в частности, в
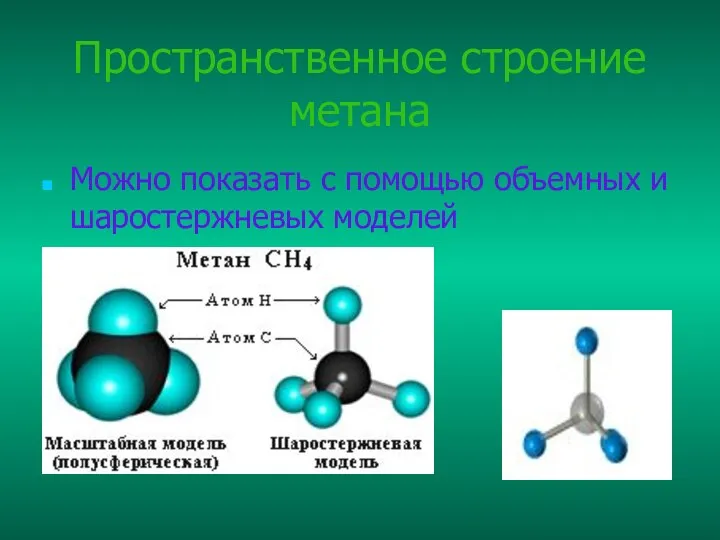
- 5. Пространственное строение метана Можно показать с помощью объемных и шаростержневых моделей
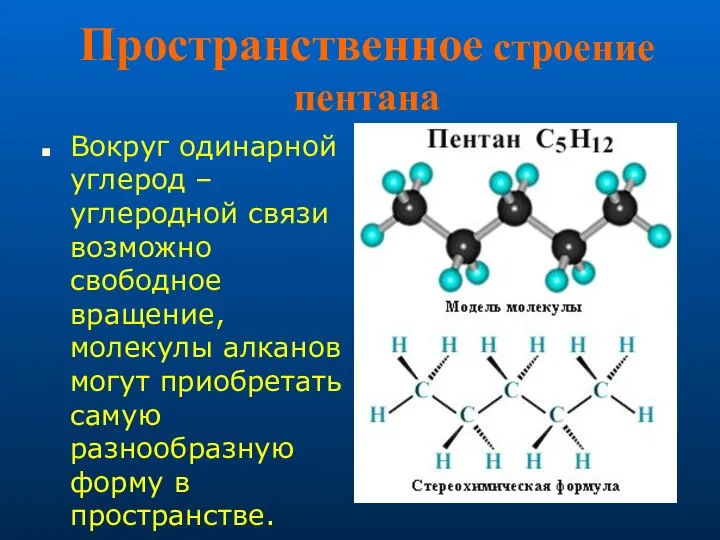
- 6. Пространственное строение пентана Вокруг одинарной углерод – углеродной связи возможно свободное вращение, молекулы алканов могут приобретать
- 7. Гомологический ряд алканов
- 8. Виды изомерии Структурная изомерия Структурные изомеры отличаются друг от друга порядком расположения атомов углерода в углеродной
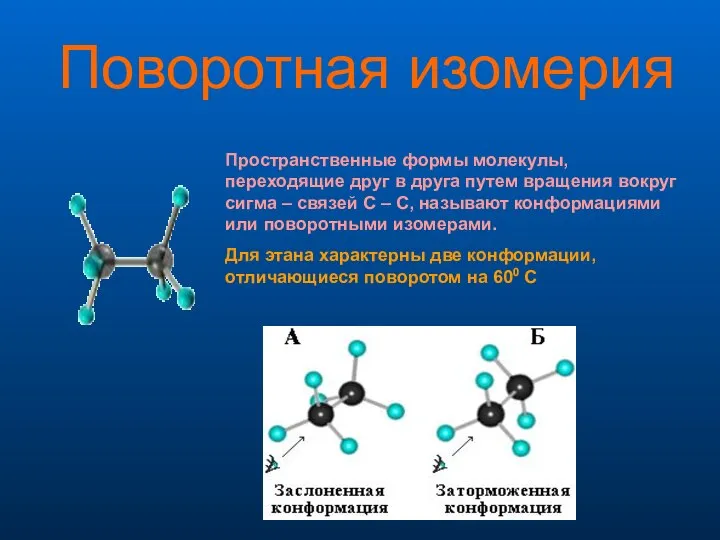
- 9. Поворотная изомерия Пространственные формы молекулы, переходящие друг в друга путем вращения вокруг сигма – связей С
- 10. Зеркальная изомерия Если атом углерода в Если атом углерода связан с четырьмя другими атомами, то возможно
- 11. Номенклатура Выбрать самую длинную цепь атомов углерода; Пронумеровать ее с той стороны, к которой ближе радикалы;
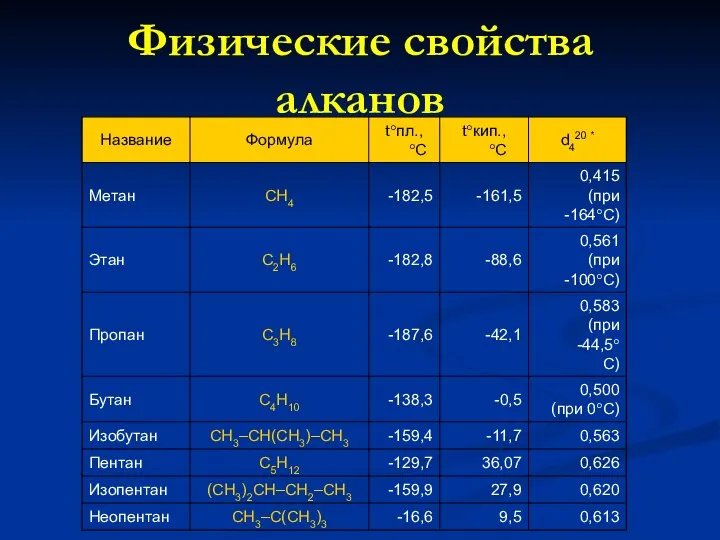
- 12. Физические свойства алканов
- 13. Общая Формула СnH2n+2 Вид изомерии - структурная Химическая связь - одинарная Длина связи С-С 0,154 нм
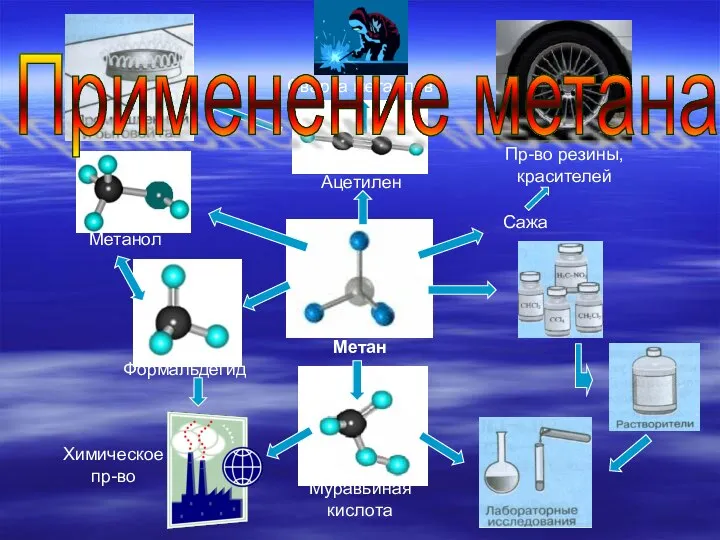
- 14. Метан Метанол Формальдегид Ацетилен Муравьиная кислота Химическое пр-во Сажа Пр-во резины, красителей Сварка металлов Применение метана
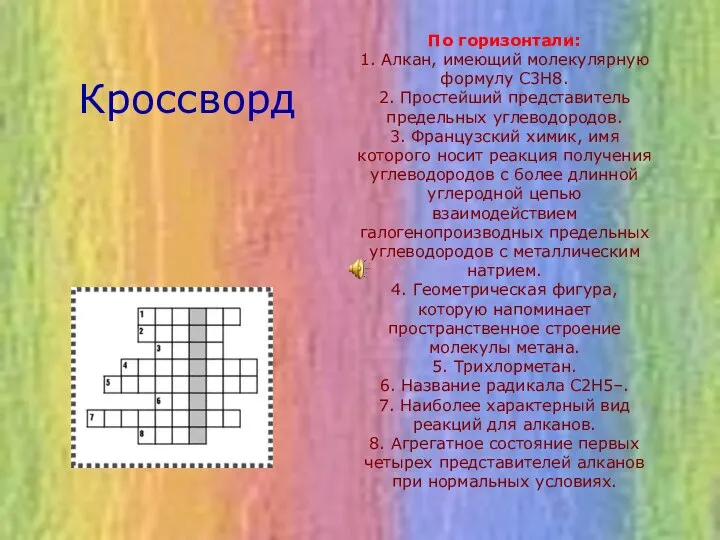
- 15. По горизонтали: 1. Алкан, имеющий молекулярную формулу С3Н8. 2. Простейший представитель предельных углеводородов. 3. Французский химик,
- 17. Скачать презентацию







 Презентация на тему Электрохимический ряд напряжений металлов
Презентация на тему Электрохимический ряд напряжений металлов  Дисперсные системы с твёрдой средой и газообразной фазой
Дисперсные системы с твёрдой средой и газообразной фазой _Периодический закон. Распределение электронов по энергетическим уровням и подуровням (1)
_Периодический закон. Распределение электронов по энергетическим уровням и подуровням (1) Молярный объем
Молярный объем Щелочные металлы — это элементы главной подгруппы I группы
Щелочные металлы — это элементы главной подгруппы I группы Металлом называется светлое тело, которое ковать можно
Металлом называется светлое тело, которое ковать можно Презентация на тему Нанохимия
Презентация на тему Нанохимия  Элементы и атомы, В менделеевский взяты круг Сделали химию самой богатой И самой творческой из наук.
Элементы и атомы, В менделеевский взяты круг Сделали химию самой богатой И самой творческой из наук. Современная аналитическая химия.Учебная литература
Современная аналитическая химия.Учебная литература Урок № 4
Урок № 4 Фторопласты и их использование
Фторопласты и их использование Свойства солей, оксидов, оснований
Свойства солей, оксидов, оснований Криогенный разрыв пласта
Криогенный разрыв пласта Астат. Свойства астата
Астат. Свойства астата Презентация на тему Сведения о воде
Презентация на тему Сведения о воде  Стероиды. Дицетин-холестерин-ацилтрансферазная реакция
Стероиды. Дицетин-холестерин-ацилтрансферазная реакция Направление процесса. ОВР
Направление процесса. ОВР Гликолиз. Глюконеогенез. Пентозофосфатный путь
Гликолиз. Глюконеогенез. Пентозофосфатный путь Применение центрифугирования
Применение центрифугирования Основания. 8 класс
Основания. 8 класс Презентация по Химии "Строение и физические свойства металлов"
Презентация по Химии "Строение и физические свойства металлов"  Химические свойства металлов. Электрохимический ряд напряжения металлов
Химические свойства металлов. Электрохимический ряд напряжения металлов Звездный час. Конкурс химиков
Звездный час. Конкурс химиков Bool-doser team
Bool-doser team Вещество. Свойства вещества. Урок №2
Вещество. Свойства вещества. Урок №2 Титриметрический анализ
Титриметрический анализ Проточные реакторы непрерывного действия. (Лекция 5)
Проточные реакторы непрерывного действия. (Лекция 5) Химический анализ
Химический анализ