Слайд 2Вскрыть причину образования химической связи
Актуализировать знания о видах химической связи
Показать относительный характер

ее классификации.
Цель урока:
Слайд 3 Причиной образования химической связи является стремление системы к минимуму энергии: при

её образовании, как правило, энергия выделяется, образующаяся система обладает меньшей энергией, чем изолированные атомы.
Происходит уменьшение энергии на величину энергии связи(Есв.).
Энергия связи (Есв.)- энергия, необходимая для разрушения этой связи.
Слайд 4Химическая связь- взаимодействие между атомами, приводящее к образованию устойчивой системы- молекулы, иона,

кристалла.
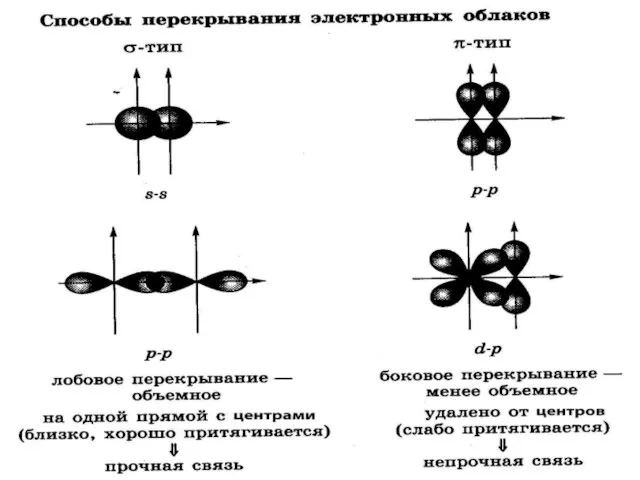
Слайд 5Ковалентная связь- связь между атомами, возникающая за счёт образования общих электронных пар.

Способы образования общей электронной пары:
- двумя неспаренными электронами-обменный механизм:
А . + .В = А : В или А-В (1:1)
-электронной парой и свободной орбиталью- донорно- акцепторный механизм:
А: + В= А : В или А-В (2:0)
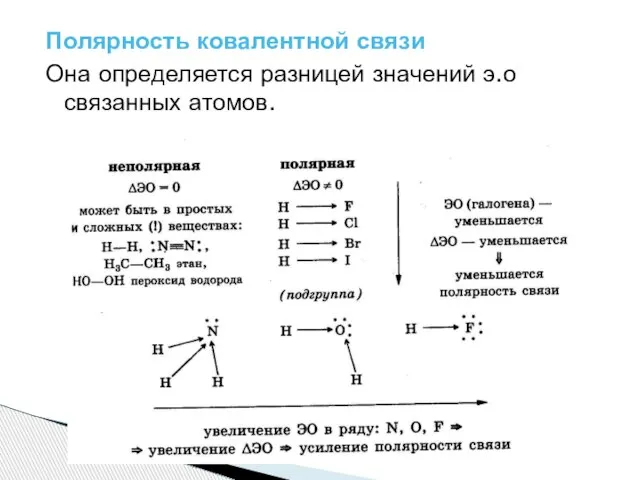
Слайд 6Полярность ковалентной связи
Она определяется разницей значений э.о связанных атомов.
Слайд 9 Ионная связь- электростатическое притяжение между ионами.
Ионных соединений немного:
элементы + элементы
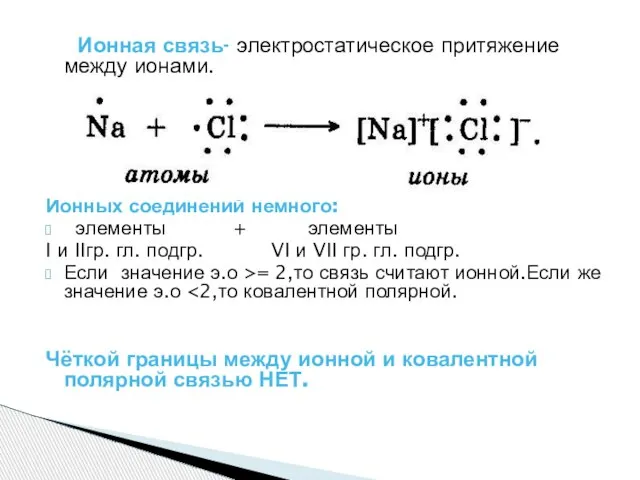
I и IIгр. гл. подгр. VI и VII гр. гл. подгр.
Если значение э.о >= 2,то связь считают ионной.Если же значение э.о <2,то ковалентной полярной.
Чёткой границы между ионной и ковалентной полярной связью НЕТ.
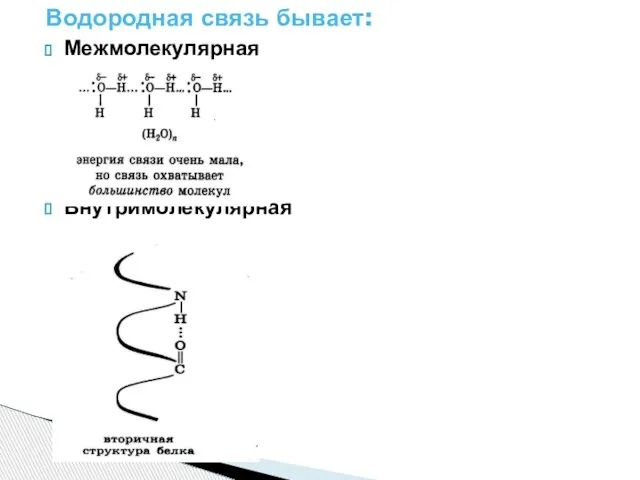
Слайд 11Водородная связь- электростатической притяжение между положительно поляризованными атомами водорода одной молекулы и

отрицательно поляризованными атомами( F,O,N, реже S,Cl) другой молекулы.
Слайд 12Водородная связь бывает:
Межмолекулярная
Внутримолекулярная









 Предельные углеводороды насыщенные, парафины, алканы
Предельные углеводороды насыщенные, парафины, алканы Органическая химия- химия соединений углерода
Органическая химия- химия соединений углерода Презентация на тему Кремний и его соединения
Презентация на тему Кремний и его соединения  Ковалентная полярная химическая связь
Ковалентная полярная химическая связь Алюминий и его соединения
Алюминий и его соединения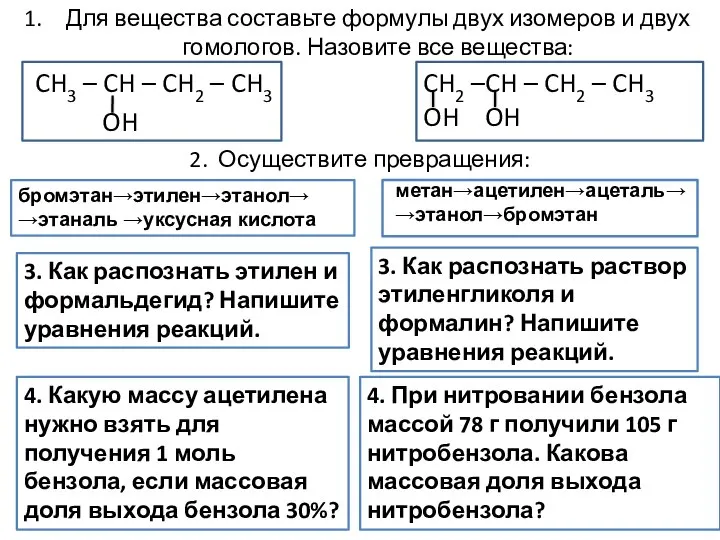 Формулы двух изомеров и двух гомологов
Формулы двух изомеров и двух гомологов Кислоты, их классификация и свойства
Кислоты, их классификация и свойства Органическая химия. Ароматические углеводороды
Органическая химия. Ароматические углеводороды Химия. 8 класс. Подготовка к контрольной работе
Химия. 8 класс. Подготовка к контрольной работе Нанотехнологии в быту
Нанотехнологии в быту Аналитические методы в современных исследованиях химии
Аналитические методы в современных исследованиях химии Биохимия крови
Биохимия крови Элементы принадлежащие к VII группе периодической таблицы - галогены
Элементы принадлежащие к VII группе периодической таблицы - галогены Неметаллы. Общая характеристика
Неметаллы. Общая характеристика Жесткость воды и способы ее устранения
Жесткость воды и способы ее устранения Самостоятельные работы по разделу Химические реакции в рамках рабочей программы по химии для 8 класса
Самостоятельные работы по разделу Химические реакции в рамках рабочей программы по химии для 8 класса Лекция № 1
Лекция № 1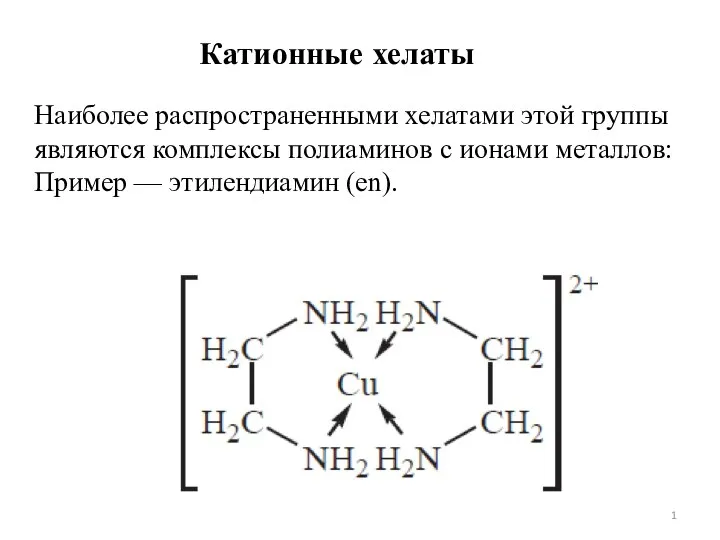 Хелатный эффект. Лекция 7
Хелатный эффект. Лекция 7 Классификация углеводородов
Классификация углеводородов Массовые доли веществ задачи
Массовые доли веществ задачи Классификация аминокислот в зависимости от природы радикалов
Классификация аминокислот в зависимости от природы радикалов Спирты. Общая формула, номенклатура
Спирты. Общая формула, номенклатура Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Урок №2
Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Урок №2 Презентация на тему Фосфорная кислота и ее свойства
Презентация на тему Фосфорная кислота и ее свойства  Вещество. Свойства веществ
Вещество. Свойства веществ Минералы
Минералы Относительная атомная масса
Относительная атомная масса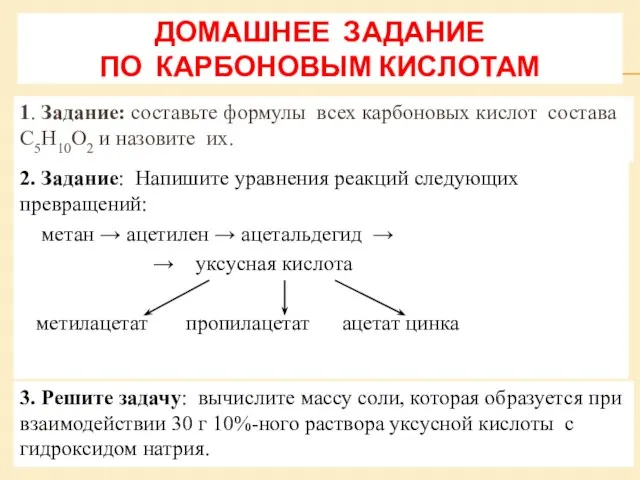 Карбоновые кислоты
Карбоновые кислоты