Содержание
- 2. ЧЕТВЕРТЫЙ ПЕРИОД ПОБОЧНАЯ ПОДГРУППА ВОСЬМОЙ ГРУППЫ ТЕМПЕРАТУРА ПЛАВЛЕНИЯ ЖЕЛЕЗА 15390С
- 3. ПЕРВОЕ ПИСЬМЕННОЕ УПОМИНАНИЕ О ЖЕЛЕЗЕ ОТНОСИТСЯ К 1450 – 1400 ГОДУ ДО НОВОЙ ЭРЫ. Железо —
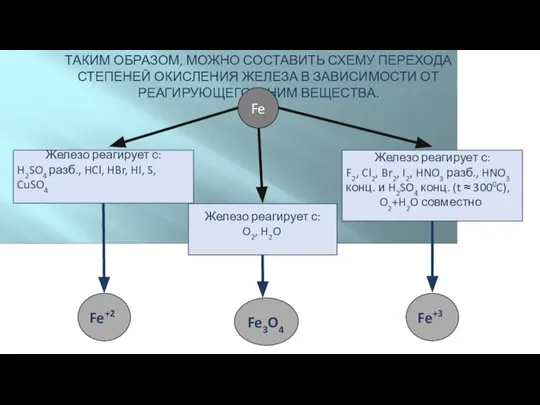
- 5. ТАКИМ ОБРАЗОМ, МОЖНО СОСТАВИТЬ СХЕМУ ПЕРЕХОДА СТЕПЕНЕЙ ОКИСЛЕНИЯ ЖЕЛЕЗА В ЗАВИСИМОСТИ ОТ РЕАГИРУЮЩЕГО С НИМ ВЕЩЕСТВА.
- 6. ВАЖНЕЙШИЕ СОЕДИНЕНИЯ ЖЕЛЕЗА FeO Оксиды железа: Бурый железняк, лимонит. Основный оксид Fe2O3 Красный железняк, гематит. Амфотерный
- 7. Гидроксид железа(III) образуется в результате коррозии железа. Внимание! Самостоятельно расставьте коэффициенты в этом уравнении методом электронного
- 8. Железо способно вытеснять металлы, стоящие правее него в ряду напряжения, из растворов солей. Раствор сульфата меди
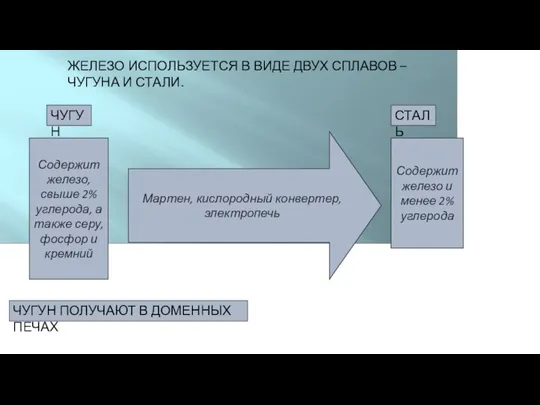
- 9. ЖЕЛЕЗО ИСПОЛЬЗУЕТСЯ В ВИДЕ ДВУХ СПЛАВОВ – ЧУГУНА И СТАЛИ. ЧУГУН Содержит железо, свыше 2% углерода,
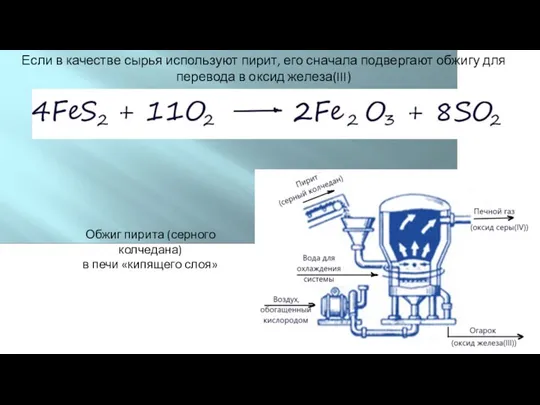
- 10. Если в качестве сырья используют пирит, его сначала подвергают обжигу для перевода в оксид железа(III) Обжиг
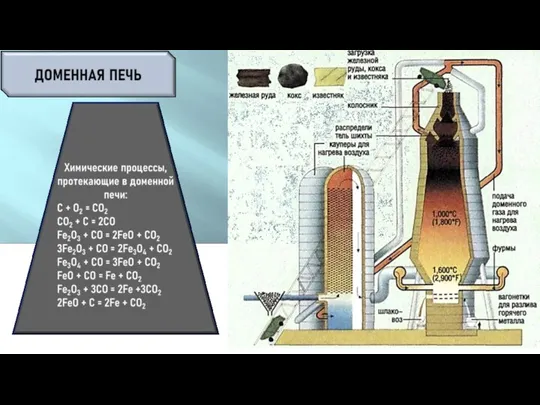
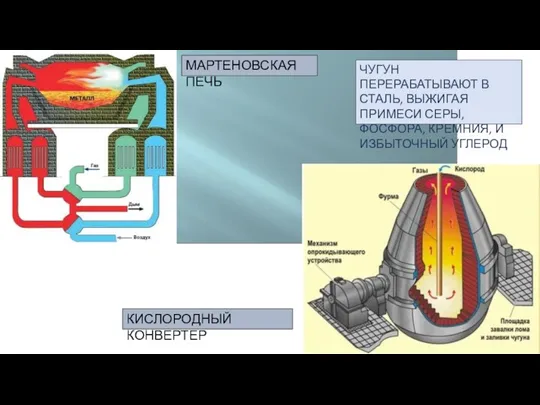
- 12. МАРТЕНОВСКАЯ ПЕЧЬ КИСЛОРОДНЫЙ КОНВЕРТЕР ЧУГУН ПЕРЕРАБАТЫВАЮТ В СТАЛЬ, ВЫЖИГАЯ ПРИМЕСИ СЕРЫ, ФОСФОРА, КРЕМНИЯ, И ИЗБЫТОЧНЫЙ УГЛЕРОД
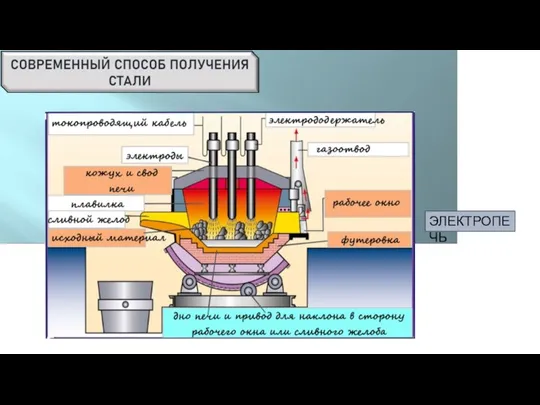
- 13. ЭЛЕКТРОПЕЧЬ
- 14. В УСЛОВИЯХ ПОВЫШЕННОЙ ВЛАЖНОСТИ ЖЕЛЕЗО ПОДВЕРГАЕТСЯ КОРРОЗИИ (РЖАВЛЕНИЮ). Вещество белого цвета Вещество бурого цвета (ржавчина) ВНИМАНИЕ!
- 16. Скачать презентацию







 Металлургия в химии
Металлургия в химии Интеллектуальный турнир для старшеклассников Умножая таланты 2020
Интеллектуальный турнир для старшеклассников Умножая таланты 2020 Классификация видов износа
Классификация видов износа Степень окисления
Степень окисления Udens ipasibas
Udens ipasibas Химия жиров (липидов)
Химия жиров (липидов) Коррозия металлов
Коррозия металлов Атомы химических элементов
Атомы химических элементов Повторение пройденного
Повторение пройденного Арены
Арены Простые вещества – металлы. Общие физические свойства металлов
Простые вещества – металлы. Общие физические свойства металлов Электрохимия. Решение задач. ИДЗ 4
Электрохимия. Решение задач. ИДЗ 4 Кислоты. Тест
Кислоты. Тест Пакет заданий №2. Команда вечерний дозор
Пакет заданий №2. Команда вечерний дозор Использование комплексно-ориентированных заданий на уроках
Использование комплексно-ориентированных заданий на уроках Принципы строения молекулы дезоксирибонуклеиновой кислоты: комплементарность нуклеотидов
Принципы строения молекулы дезоксирибонуклеиновой кислоты: комплементарность нуклеотидов Изменение химмотологических свойств цетанповышающей присадки в процессе хранения
Изменение химмотологических свойств цетанповышающей присадки в процессе хранения Различные виды красителей
Различные виды красителей G11. Химический состав
G11. Химический состав Спирты. Классификация, изомерия спиртов. Физические и химические свойства спиртов
Спирты. Классификация, изомерия спиртов. Физические и химические свойства спиртов Основи молекулярно-кінетичної теорії
Основи молекулярно-кінетичної теорії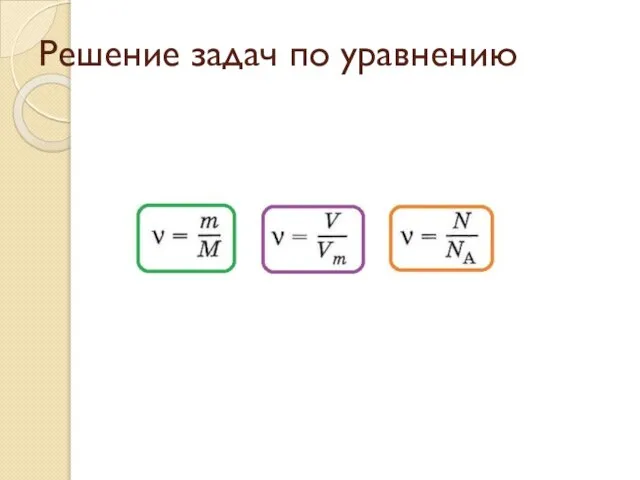 Решение задач по уравнению
Решение задач по уравнению Дождь из облака
Дождь из облака Презентация на тему Коррозия металлов (9 класс)
Презентация на тему Коррозия металлов (9 класс)  Проантоцианидины. Антиоксидантные и антирадикальные свойства
Проантоцианидины. Антиоксидантные и антирадикальные свойства Ниобий. Физиологическое действие
Ниобий. Физиологическое действие Жаңа синтетикалық есірткілер
Жаңа синтетикалық есірткілер Методы пробоотбора и пробоподготовки донных отложений, почв и грунтов
Методы пробоотбора и пробоподготовки донных отложений, почв и грунтов