Слайд 2овр
Окислительно-восстановительные реакции – реакции, протекающие с изменением степеней окисления атомов элементов.

Слайд 3конспект
Степень окисления: - это заряд, который возникает на атомах в результате перехода

электронов (условного или действительного) при образовании химической связи.
Элементы с постоянной степенью окисления:
Н, кроме +1
соединений с ме, где - 1
F - 1
O, кроме - 2
Соединения ОF2 , где + 2
элементы I гр. гл.п/г + 1
элементы II гр .гл.п/г +2
элементы III гр. гл.п/г +3
У остальных элементов переменная степень окисления, которая рассчитывается исходя из правила: алгебраическая сумма степеней окисления атомов в молекуле = 0
Пример:
Правила в определении степени окисления
Атомы простого вещества имеют степень окисления = 0 ,
У мe всегда (+) степень окисления
У неме: (+) и (-) = 8 – N гр.
Элемент с (+) ст.ок. пишется на 1 месте
Элемент с (-) ст.ок пишется на последнем месте
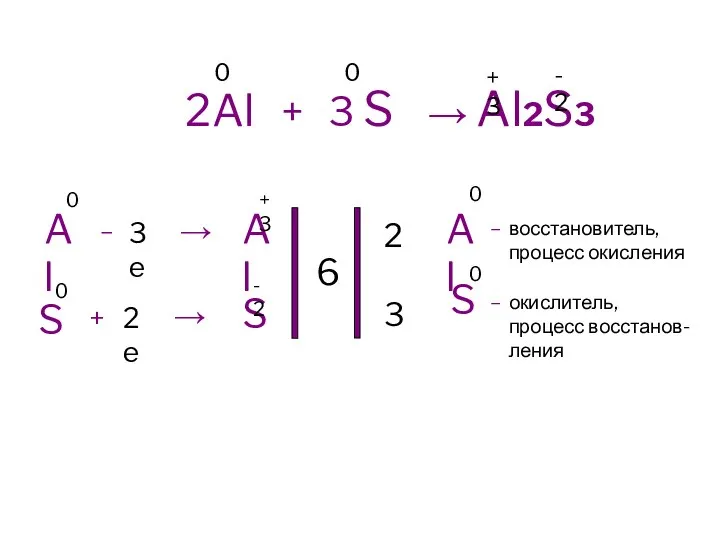
Слайд 42Al + 3 S → Al2S3
0
0
+3
-2
Al
0
–
3e
→
Al
+3
S
0
+
2e
→
S
-2
6
2
3
Al
0
–
S
0
–
восстановитель,
процесс окисления
окислитель,
процесс восстанов-
ления
Слайд 5 Восстановитель –
элемент, который
отдает электроны.
Окислитель –
элемент, который
принимает электроны.
S

– 2e → S
0
+2
P + 3e → P
0
- 3
S – 2e → S
0
Слайд 6Процесс окисления –
это процесс отдачи электронов.
Процесс восстановления –
это процесс присоединения
электронов.
S

– 2e → S
0
+ 2
P + 3e → P
0
- 3
Слайд 7Овр с составлением уравнений Электронного баланса
Уравнения электронного баланса
Zn + 2HCl = Zn

Cl2 + H2
+1
0
-1
-1
0
+2
Окислитель
Восстановитель
Слайд 8Д.з. расставить степень окисления над элементами во всех уравнениях и составить уравнения

электронного баланса в уравнениях №3 и №4
Слайд 9 Значение
окислительно-
восстановительных
реакций

Слайд 10фотосинтез
О2
О2
О2
О2
CO2 + H2O → C6H12O6 + O2

Слайд 11Коррозия металлов
Fe +H2O +O2 → Fe(OH)3

Слайд 13Взрывчатые вещества
P + KClO3 → P2O5 + KCl












 Нефть. Состав, свойства, переработка
Нефть. Состав, свойства, переработка Закон сохранения массы веществ. 8 класс
Закон сохранения массы веществ. 8 класс Золото (Au)
Золото (Au) Презентация на тему Важнейшие классы неорганических соединений
Презентация на тему Важнейшие классы неорганических соединений  Строение атома
Строение атома Rozcieńczanie i zatężanie roztworów
Rozcieńczanie i zatężanie roztworów Порох: из грязи в князи
Порох: из грязи в князи Полимеры. Полиэтилен
Полимеры. Полиэтилен Металлы
Металлы Свойства кислот, оснований и солей как электролитов
Свойства кислот, оснований и солей как электролитов Соединения щелочноземельных металлов
Соединения щелочноземельных металлов Анализ спорных ситуаций при оценивании заданий с развернутым ответом. Химия
Анализ спорных ситуаций при оценивании заданий с развернутым ответом. Химия Общая характеристика элементов VII группы главной подгруппы. Хлор
Общая характеристика элементов VII группы главной подгруппы. Хлор Алкены
Алкены Презентация на тему Знаки химических элементов
Презентация на тему Знаки химических элементов  Электролитическая диссоциация веществ Реакции ионного обмена и условия их протекания
Электролитическая диссоциация веществ Реакции ионного обмена и условия их протекания Презентация на тему Круговорот углерода в природе
Презентация на тему Круговорот углерода в природе  Чугуны
Чугуны Взаимодействие с водой
Взаимодействие с водой Серная кислота
Серная кислота Понятие о полимерах
Понятие о полимерах Открытый урок по химии в 8 классе по теме: «Первоначальные химические понятия». Учитель химии ГБОУ СОШ № 650 Безверхова Олеся Влад
Открытый урок по химии в 8 классе по теме: «Первоначальные химические понятия». Учитель химии ГБОУ СОШ № 650 Безверхова Олеся Влад Аппаратура ионообменных процессов
Аппаратура ионообменных процессов Primenenie_kauchukov
Primenenie_kauchukov Строение воды
Строение воды Проблемное обучение на уроках химии
Проблемное обучение на уроках химии Карбоновые кислоты
Карбоновые кислоты Фосфорорганические соединения
Фосфорорганические соединения