Содержание
Слайд 5Теорія електролітичної дисоціації
Теорія електролітичної дисоціації для водних розчинів була сформульована шведським ученим
Теорія електролітичної дисоціації
Теорія електролітичної дисоціації для водних розчинів була сформульована шведським ученим

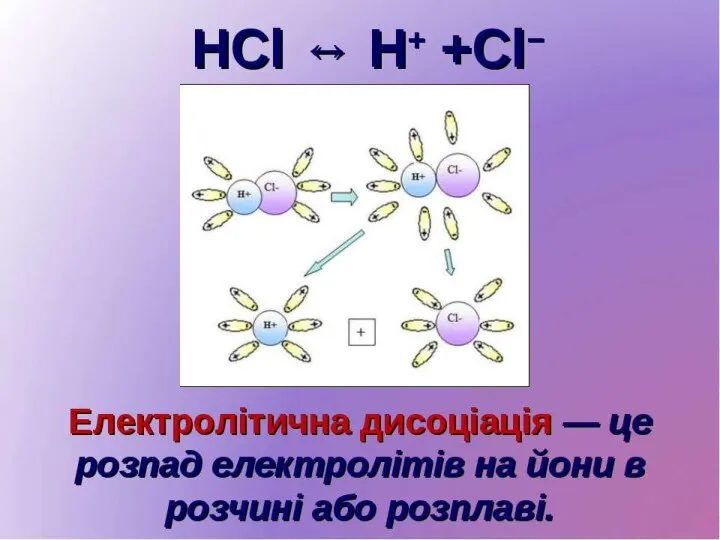
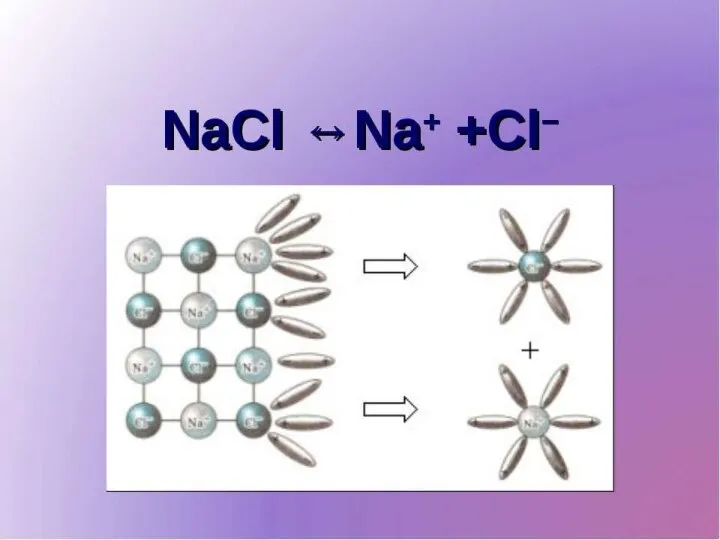
При розчиненні у воді молекули електролітів дисоціюють (розщеплюються) на позитивно і негативно заряджені іони. Іони можуть бути утворені з одного атома - прості іони ( Na+, Cl- ) і кількох атомів - складні іони (Са+, ОН-).
Слайд 283
ТЕМА «
КІНЕТИКА БІОХІМІЧНИХ РЕАКЦІЙ
.
Х
ІМІЧНА
РІВНОВАГА. ДОБУТОК РОЗЧИННОСТІ»
1.
Кількість годин
4
2
.
Матеріальне та
3
ТЕМА «
КІНЕТИКА БІОХІМІЧНИХ РЕАКЦІЙ
.
Х
ІМІЧНА
РІВНОВАГА. ДОБУТОК РОЗЧИННОСТІ»
1.
Кількість годин
4
2
.
Матеріальне та
Таблиці:
1.
Графологічна структура теми.
2. Значення констант Міхаеліса
-
Ментен (К
м
) для деяких ферментів
.
3
.
Кінетика ферментативних
процесів
.
4.
З
алежність швидкості ферментативних реа
кцій від концентрації
субстрата.
5. Мультимедійне забезпечення (п
р
езентація, навчальний фільм).
Навчально
-
методична література:
1.
Медична хімія
: підручник / В.О. Калібабчук, І.С. Чекман, Г.О
. Сирова,
В.І.
Галинська т
а
ін..; за ред. проф. В.О. Калібабчук.
–
К.:
ВСВ «Медицина»,
2013.
–
336 с. (Затверджено Міністерством освіти і науки України (лист МОН
України No1/11
-
1152 від 05.02.13) та Міністерством охорони здоров
’
я України
як базовий підручник для студентів вищих навч
альних закладів
IV
рівня
акредитації (напрями «Лікувальна справа» та «Стоматологія»).
2
.
Завг
ородн
і
й
І
.В.,
Сирова Г.О., Ткачук Н.М. та ін.
Медична хімія.
Навчальний посібник рекомендований МОЗ та МОН України як навчальний
посібник для самостійної роботи сту
дентів вищих медичних навчальних
закладів
IV
рівня акредитації,
Харків, ХНМУ, 2010.
–
268
с
.
3
.
Завгородній І.В., Ткачук Н.М., Петюніна В.М. та ін. Навчальний
посібник для самостійної роботи студентів медичного факультету по курсу
«Медична хімія» Модуль
2: «Рівновага в біологічних системах на межі
розподілу фаз»
, Харків, ХНМУ, 2008.
–
116 с.
4
. Робочий зошит для самостійної роботи студентів з курсу «Медична
хімія»
Харкі
в, ХНМУ,
2013.
–
72 с.
4
5
. Методичні вказівки для самостійної роботи студентів з курсу
«Медична хімія»
за темою «
Кінетика біохімічних реакцій
.
Хімічна рівновага.
Добуток розчинності
».
6
. Конспект лекції
Лабораторний посуд та реактиви для проведення лабораторної роботи
«Вивчення
кінетики хімічної реакції
» (штативи з бюретками, розчини
37,
0 г/л
Na
2
S
2
O
3
та
H
2
S
O
4
(1:200)
,
мірн
і
циліндр
и
, секундомір, термометр
.
3
.
Обґрунтування теми.
Вивчення кінетики хімічних реакцій має велике
теоретичне і практичне значення як для хімії, так і для медицини. Знання
чинників, від яких залежить швидкість реакц
ії дозволяє регулювати процеси,
які відбуваються в організмі, вивчати ефективність дії лікарських препаратів,
ферментів. Знання зак
онів, що забезпечують оптимальний
п
еребіг того,
або
іншого процесу
,
дозвол
яє
досягти бажаного результату за рахунок створенн
я
відповідних умов.
Вивчення даної теми дозволить аналізувати послідовність
перебігу конкуруючих процесів в організмі, зрозуміти причини порушення
обміну речовин, що відбува
ю
т
ь
ся в живих системах.
4
.
Мета заняття:
-
загальна:
в
міти
пояснювати основні кіне
тичні закономір
ності перебігу
хімічних та
ферментативних реакцій
;
інтерпретувати фізичну суть хімічної
рівноваги
.
-
конкретна: аналізувати залежність швидкості реакцій від концентрації та
температури, інтерпретувати залежність швидкості реакції від енерг
ії активації,
аналізувати особливості дії каталізаторів та пояснювати механізм гомогенного
та гетерогенного каталізу, пояснювати механізм дії ферментів та аналізувати
залежність швидкості ферментативних процесів від концентрації ферменту та
субстрату, анал
ізувати хімічну рівновагу та пояснювати її умову з позиції
термодинаміки та кінетики, пояснювати вплив зовнішніх факторів на хімічну
рівновагу, аналізувати умови випадіння та розчинення осад
ів, пояснювати роль
гетерогенних
рівноваг за участю солей в загал
ьному гомеостазі організму;
5
а)
знати:
основні
поняття
хіміч
ної
кінетики
:
швидкість хімічної реакції
,
константа швидкості хімічної реакції
,
гомогенна та гетерогенна систем
и
;
б)
вміти:
визначати
залежність швидкості х
імічної реакції від
температури
й конце
нтрації реагуючих речовин
,
в
изначати кінетичні
параметри: порядок, молекулярність реакції
,
і
нтерпретувати залежність
швидкості хімічної реакції від енергії активації, пояснювати особливості дії
каталізаторів
, п
ояснювати механізм дії ферментів і особливості
ферментативного каталізу
,
а
налізувати хімічну рівновагу і пояснювати
її
з
позиції термодинаміки і кінетики
,
п
ояснювати вплив зовнішніх чинників на
хімі
ч
ну
рівновагу
,
а
налізувати умови випадання і розчинення о
с
ад
ів,
пояснювати роль гетерогенних
рівноваг
за
участю солей в загальному
гомеостазі організму.
5
.
Гра
фо
логічна структура
теми.
Природа реагуючих речовин
Молекулярність
Механізм хімічних реакцій
Константа
швидкості
реакції
Швидкість
хімічних
реакції
Константи
хімічної
рівноваги
Оптим
альні
умови
проведення
хім.
реакцій
Каталізатор
Ен
ергія
активації
Рівняння
Арреніуса
Температура
Закон Вант
-
Гоффа
Концентрація
реагентів
Прядок
реакції
Закон
діючих мас






























 Физическая и коллоидная химия
Физическая и коллоидная химия Электролитическая диссоциация
Электролитическая диссоциация Классификация реакций. Таблица
Классификация реакций. Таблица Неорганическая и органическая химия
Неорганическая и органическая химия Презентация на тему Теория электролитической диссоциации 8 класс
Презентация на тему Теория электролитической диссоциации 8 класс  Создание теплостойких эластомерных материалов на основе фторкаучуков
Создание теплостойких эластомерных материалов на основе фторкаучуков Презентация на тему Викторина "Узнай химический элемент"
Презентация на тему Викторина "Узнай химический элемент"  VII Межрегиональная метапредметная конференции Удивительный мир научных книг. Ситуационные задания по химии
VII Межрегиональная метапредметная конференции Удивительный мир научных книг. Ситуационные задания по химии Реакции ионного обмена
Реакции ионного обмена Метионин
Метионин Химические средства защиты растений
Химические средства защиты растений Номенклатура и изомерия алкенов
Номенклатура и изомерия алкенов Формула любви
Формула любви Презентация на тему В мире полимеров
Презентация на тему В мире полимеров  Органические полимеры
Органические полимеры Расчетная работа. Тепловой эффект клинкерообразования
Расчетная работа. Тепловой эффект клинкерообразования Природные источники углеводородов
Природные источники углеводородов Обобщение и подготовка к химии 8 класс
Обобщение и подготовка к химии 8 класс Соединения галогенов
Соединения галогенов Уксусная кислота
Уксусная кислота Подготовка проб товаров к анализу. Химико-аналитический контроль
Подготовка проб товаров к анализу. Химико-аналитический контроль Проект синтеза бензина для промышленных целей отделения Д-3 цеха Д 2-6-3-5-12
Проект синтеза бензина для промышленных целей отделения Д-3 цеха Д 2-6-3-5-12 Путешествие по морю
Путешествие по морю Комплексное изучение системы NiO-ZnO-CoO с целью модифицирования свойств исходной матрицы никель-цинкового феррита xZnxFe2O4
Комплексное изучение системы NiO-ZnO-CoO с целью модифицирования свойств исходной матрицы никель-цинкового феррита xZnxFe2O4 Способы разделения нефти. Ректификация
Способы разделения нефти. Ректификация Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Реакции в органической химии
Реакции в органической химии Презентация на тему Катализ
Презентация на тему Катализ