Содержание
- 2. Распространенность металлов в природе Содержание некоторых элементов металлов в земной коре: Алюминий-8,2% Железо-5,0% Кальций-4,1% Натрий-2,3% Магний-2,3%
- 3. Минералы и горные породы, содержащие металлы или их соединения и пригодные для промышленного получения металлов, называются
- 4. Металлургия Отрасль промышленности, которая занимается получением металлов из руд Наука о промышленных способах получения металлов из
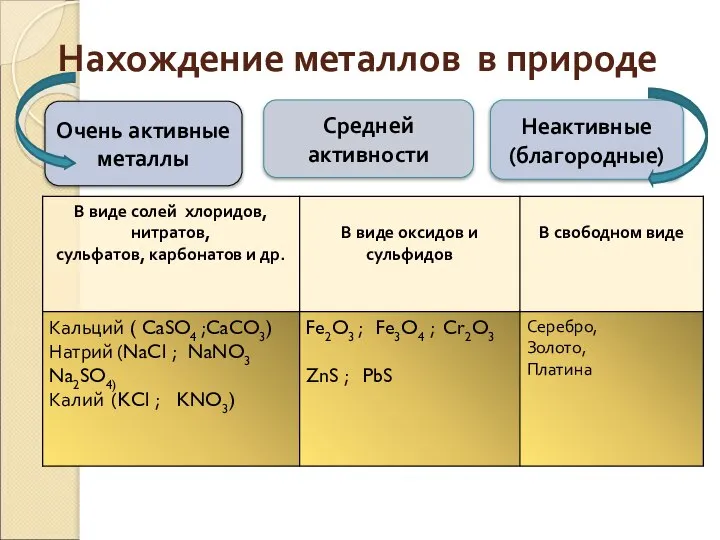
- 5. Нахождение металлов в природе Очень активные металлы Неактивные (благородные) Средней активности
- 6. Самородные металлы золото серебро медь платина
- 7. MgCO3 Карбонаты Малахит Cu2(OH)2CO3 Магнезит Карбонат магния Мрамор CaCO3 Кварц SiO2
- 8. Хлориды Каменная соль NaCl Карналлит KCl*MgCl2*6H2O Апатит Ca3(PO4)2 Сильвин Хлорид калия KCl Галит NaCl
- 9. Галенит - PbS Пирит FeS2 Медный блеск - Сульфид меди (II) CuS Сульфиды Цинковая обманка (сфалерит)
- 10. Fe2O3 Оксиды Магнетит Fe3O4 Лимонит 2Fe2O3* 3H2O Гематит Оксид железа (III) Каолин Al2O3*2SiO2*2H2O Флюорит CaF2
- 11. Способы получения металлов
- 12. Способы получения металлов Пирометаллургия Гидрометаллургия Электрометаллургия (электролиз)
- 13. Пирометаллургия – восстановление металлов из руд при высоких температурах с помощью восстановителей (C, CO, H2, металлы)
- 14. Получение из оксидов 1) Восстановление углём получают Fe, Cu, Zn, Cd, Ge, Sn, Pb и др.,
- 15. Получение из оксидов 3) Восстановление водородом (водородотермия) WO3 + 3H2 W + 3H2O Таким способом получают
- 16. Алюминотермия, магнийтермия 4) 3MnO2 + 4Al 3Mn + 2Al2O3 Таким способом получают Mn, Cr, Ti, Mo,
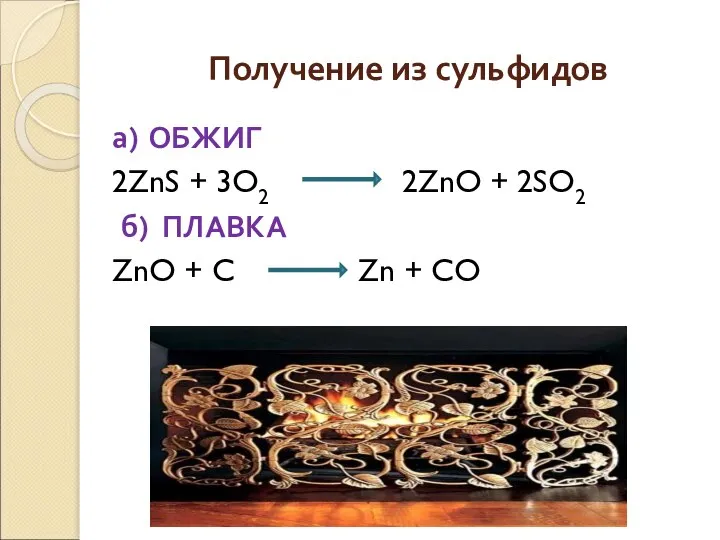
- 17. Получение из сульфидов Получение происходит по схеме: сульфиды оксиды металлы
- 18. Получение из сульфидов а) ОБЖИГ 2ZnS + 3O2 2ZnO + 2SO2 б) ПЛАВКА ZnO + C
- 19. Гидрометаллургия Гидрометаллургия – получение металлов из растворов их солей. Получение происходит по схеме: Руда раствор соли
- 20. Задание: Осуществите цепочки превращений 1. CuO CuSO4 Cu 2. ZnO ZnCL2 Zn 3. PbO Pb(NO3)2 Pb
- 21. Электрометаллургия* – способ получения металлов с помощью электрического тока (электролиз) Натрий Калий Магний Кальций Барий (Хемфри
- 22. . Электрометаллургия* - методы получения металлов, основанные на электролизе, т.е. выделение металлов из растворов или расплавов
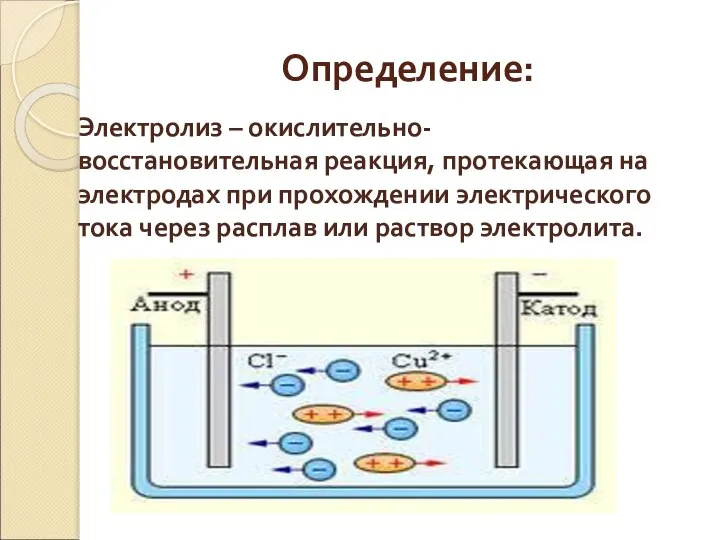
- 23. Электролиз
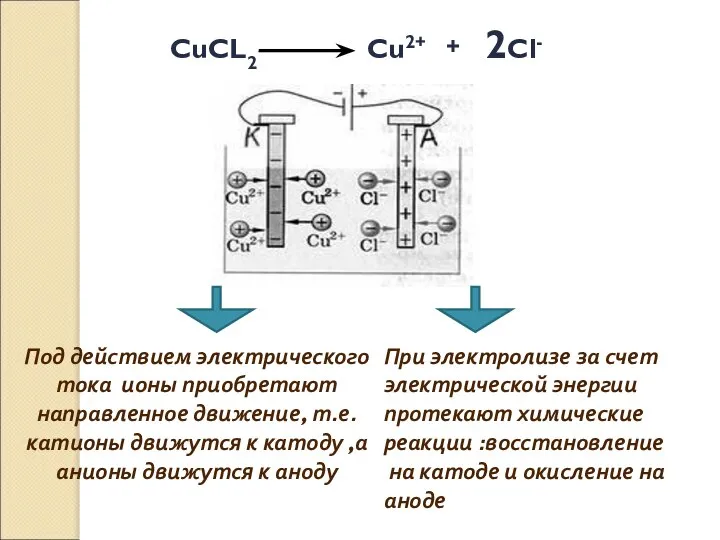
- 24. Определение: Электролиз – окислительно-восстановительная реакция, протекающая на электродах при прохождении электрического тока через расплав или раствор
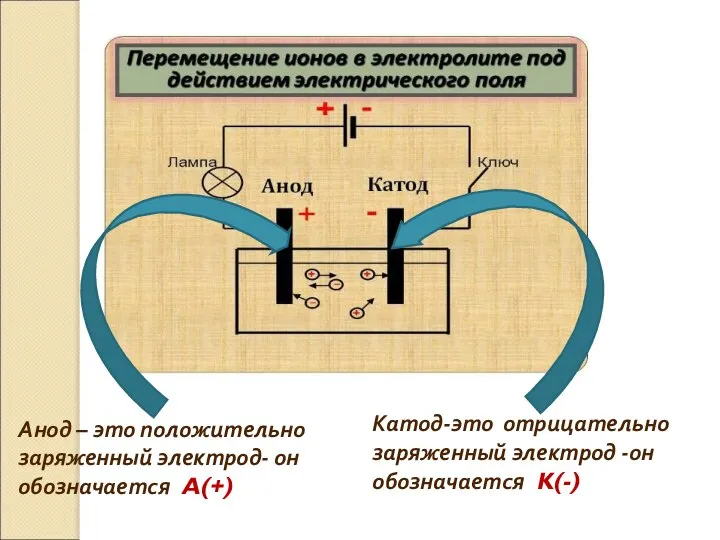
- 25. Катод-это отрицательно заряженный электрод -он обозначается K(-) Анод – это положительно заряженный электрод- он обозначается A(+)
- 26. Под действием электрического тока ионы приобретают направленное движение, т.е. катионы движутся к катоду ,а анионы движутся
- 27. Английский физик и химик, один из основателей электрохимии В конце 18 века он приобрел репутацию хорошего
- 28. Первые его работы в области электрохимии были посвящены изучению действия электрического тока на химические соединения. Он
- 29. А знаете ли вы, что….. Современную жизнь без электролиза представить себе уже невозможно….
- 31. Но…..уже в середине XIX века некоторые химики указывали на то, что алюминий можно получать путем электролиза.
- 32. При помощи электролиза монету можно покрыть тонким слоем многих металлов . Но первом фото монета покрыта
- 33. . Микробиологический метод - в этом методе используется жизнедеятельность некоторых видов бактерий. Например, тионовые бактерии способны
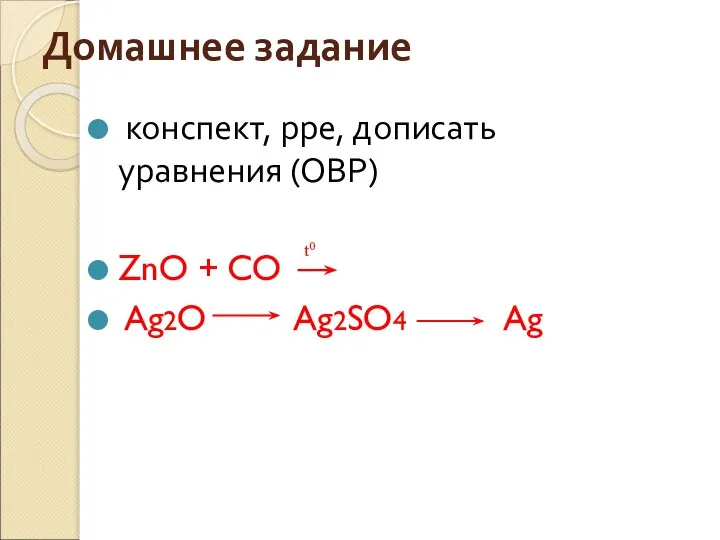
- 34. Домашнее задание конспект, рре, дописать уравнения (ОВР) ZnO + CO Ag2O Ag2SO4 Ag t0
- 36. Скачать презентацию


























 Явление аллотропии
Явление аллотропии Физические свойства алкенов
Физические свойства алкенов Земная спираль Шанкуртуа
Земная спираль Шанкуртуа Соли в свете теории электролитической диссоциации
Соли в свете теории электролитической диссоциации Смеси и взвеси веществ. Простейшие операции с веществом
Смеси и взвеси веществ. Простейшие операции с веществом Презентация на тему Обобщение сведений об основных классах неорганических веществ
Презентация на тему Обобщение сведений об основных классах неорганических веществ  Учебная дисциплина Естествознание. Раздел II. Химия
Учебная дисциплина Естествознание. Раздел II. Химия Рибонуклеиновая кислота
Рибонуклеиновая кислота Кислоты. Общая формула кислот
Кислоты. Общая формула кислот Удивительное рядом
Удивительное рядом Уравнения химических реакций
Уравнения химических реакций Строение атома
Строение атома Электронный парамагнитный резонанс. Лекция 5
Электронный парамагнитный резонанс. Лекция 5 Алканы
Алканы Виготовлення водних розчинів з заданою масовою часткою розчиненої речовини
Виготовлення водних розчинів з заданою масовою часткою розчиненої речовини Lipidy
Lipidy Классификация реагентов и реакций в органической химии. (Лекция 4)
Классификация реагентов и реакций в органической химии. (Лекция 4) Современная аналитическая химия.Учебная литература
Современная аналитическая химия.Учебная литература Общая характеристика элементов IIА группы
Общая характеристика элементов IIА группы О́лово — элемент 14-й группы периодической системы химических элементов
О́лово — элемент 14-й группы периодической системы химических элементов Материаловедение. Деформация и разрушение материалов. (Тема 4)
Материаловедение. Деформация и разрушение материалов. (Тема 4) Анализ объектов окружающей среды. Сопоставление и выбор методов анализа
Анализ объектов окружающей среды. Сопоставление и выбор методов анализа Кетоны
Кетоны Нефть. Её состав. Термический и каталитический крекинг
Нефть. Её состав. Термический и каталитический крекинг Степени окисления и формулы веществ
Степени окисления и формулы веществ Кислотность почв с.Берёзовка МОУ «СОШ с.Берёзовка» Колесников Иван, 9 класс Пряхина Виктория, 8 класс
Кислотность почв с.Берёзовка МОУ «СОШ с.Берёзовка» Колесников Иван, 9 класс Пряхина Виктория, 8 класс Сложные эфиры. Жиры
Сложные эфиры. Жиры Интересное о кристаллизации
Интересное о кристаллизации