Содержание
- 2. CnH2n+2 Химическая устойчивость алканов объясняется высокой прочностью б - связей С-С и С-Н, а также их
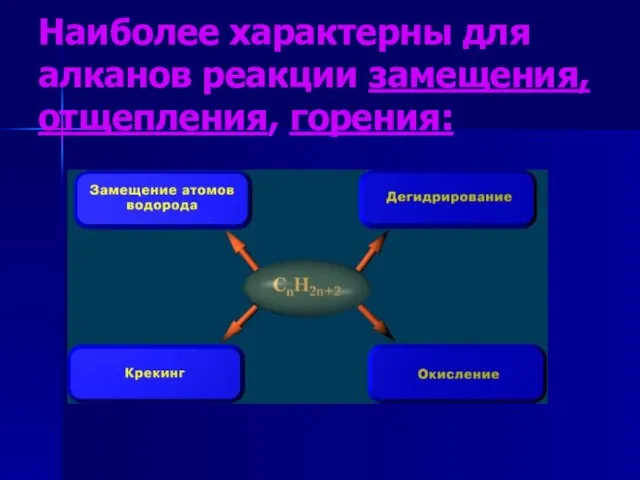
- 3. Наиболее характерны для алканов реакции замещения, отщепления, горения:
- 4. Реакции замещения. Протекают по механизму радикального замещения, обозначаемого Sr (англ. substitution radicalic). а) с галогенами (с
- 5. Механизм реакции замещения Состоит из 3 стадий: -зарождение цепи Cl2 2Cl· -развитие цепи CH4 + Cl·
- 6. Общая схема реакции Sr * Замещение у хлорметана идет легче, чем у метана, так как атом
- 7. Взаимодействие со фтором в) в атмосфере фтора происходит следующая реакция:
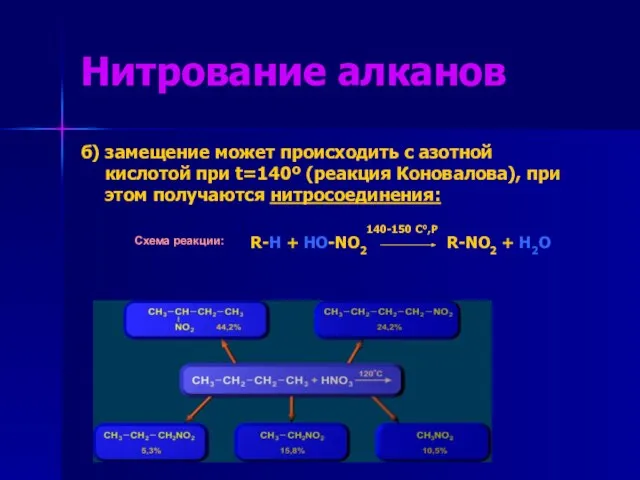
- 8. Нитрование алканов б) замещение может происходить с азотной кислотой при t=140º (реакция Коновалова), при этом получаются
- 9. Реакции отщепления. а) дегидрирование: CH3 – CH3 Pt,t° CH2=CH2 + H2 б) крекинг алканов: CH3 –
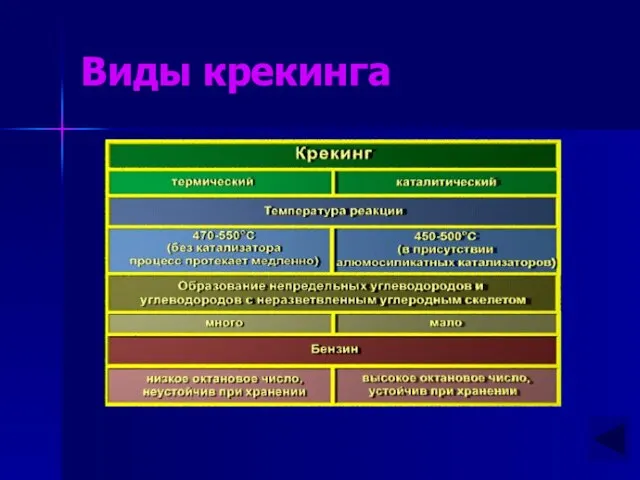
- 10. Крекинг алканов Крекинг – реакции расщепления углеродного скелета крупных молекул при нагревании и в присутствии катализаторов.
- 11. Виды крекинга
- 12. Реакции окисления. а) все алканы горят с образованием углекислого газа и воды : * б) при
- 13. Реакции изомеризации. Алканы подвергаются изомеризации при нагревании на катализаторе AlCl3 :
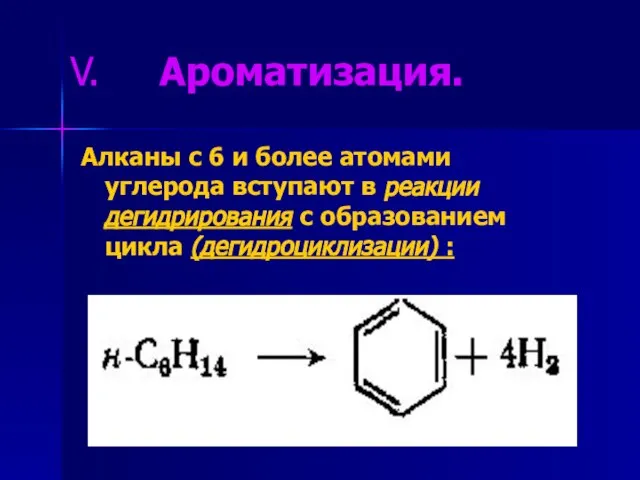
- 14. Ароматизация. Алканы с 6 и более атомами углерода вступают в реакции дегидрирования с образованием цикла (дегидроциклизации)
- 16. Скачать презентацию









 Презентация на тему Химия и здоровье человека (10 класс)
Презентация на тему Химия и здоровье человека (10 класс)  Презентация на тему Путешествие по континенту Химия, познавательная игра по химии, 8 класс
Презентация на тему Путешествие по континенту Химия, познавательная игра по химии, 8 класс  Композиционные материалы. Основные закономерности
Композиционные материалы. Основные закономерности Презентация на тему Показатели воды - её жесткость и кислотность
Презентация на тему Показатели воды - её жесткость и кислотность  Природные источники углеводородов
Природные источники углеводородов Структура периодической системы химических элементов
Структура периодической системы химических элементов Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Природные и искусственные материалы. Естествознание. 6 класс
Природные и искусственные материалы. Естествознание. 6 класс Применение алканов
Применение алканов Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Основные классы неорганических соединений. Гидроксиды
Основные классы неорганических соединений. Гидроксиды 7_ANIONY_1_angr
7_ANIONY_1_angr Презентация на тему Войди в природу другом
Презентация на тему Войди в природу другом  Химическое равновесие в растворах электролитов
Химическое равновесие в растворах электролитов Конкурс О, химия – ты муза вдохновения!
Конкурс О, химия – ты муза вдохновения! Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Презентация на тему Твердые вещества
Презентация на тему Твердые вещества  Минералы
Минералы Предмет задачи, разделы, методы физической химии. Основные понятия и законы химической термодинамики
Предмет задачи, разделы, методы физической химии. Основные понятия и законы химической термодинамики Chemické reakcie
Chemické reakcie Амины
Амины Исследование свойств модельной смеси сополимера Акритана-С с ЛД-70
Исследование свойств модельной смеси сополимера Акритана-С с ЛД-70 Сложные эфиры. Жиры
Сложные эфиры. Жиры Кристаллы, выращенные учащимися
Кристаллы, выращенные учащимися Основания, их классификация и свойства
Основания, их классификация и свойства Химические реакции. по фазовому составу
Химические реакции. по фазовому составу Циклические эфиры (окиси)
Циклические эфиры (окиси) Действие фермента каталазы на пероксид водорода
Действие фермента каталазы на пероксид водорода