Содержание
- 2. Учебная литература 1. Основы аналитической химии. В 2-х тт. Под ред. Ю.А. Золотова. М.:Высшая школа, 2004
- 3. Лекция 1 (вводная)
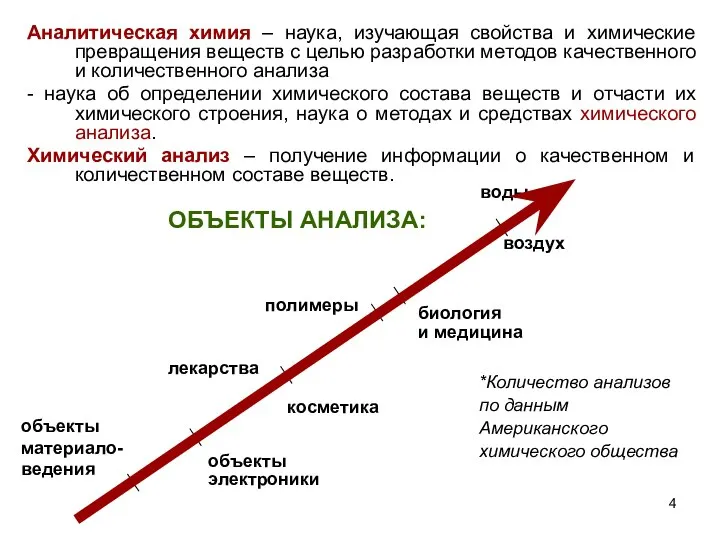
- 4. Аналитическая химия – наука, изучающая свойства и химические превращения веществ с целью разработки методов качественного и
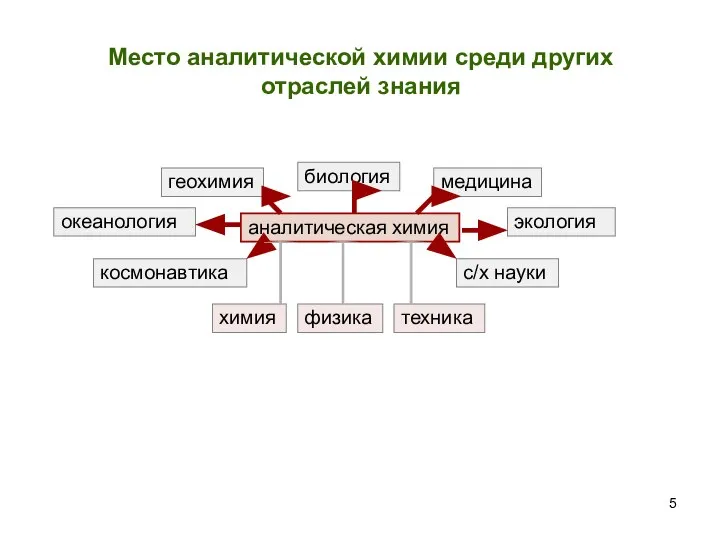
- 5. аналитическая химия геохимия биология медицина экология с/х науки космонавтика океанология химия физика техника Место аналитической химии
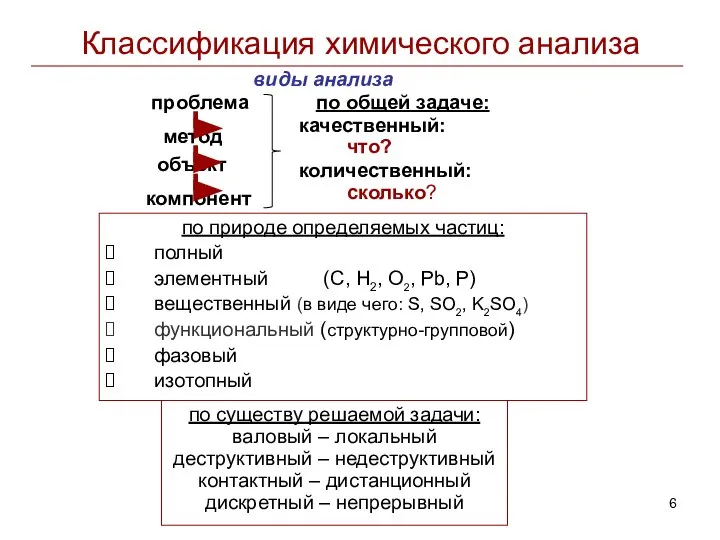
- 6. Классификация химического анализа виды анализа по природе определяемых частиц: полный элементный (C, Н2, О2, Pb, P)
- 7. Примеры массовых анализов Автомобильные выхлопы на СО. Контроль состава сырья и готовой продукции во всех отраслях
- 8. Методы аналитической химии (методики) сопровождаются аналитическим сигналом Химическое или физическое свойство, функционально связанной с содержанием компонента,
- 9. Этапы анализа: Выбор метода анализа Отбор пробы (“Основы аналитической химии”, Т.1, гл.3) Подготовка пробы к анализу
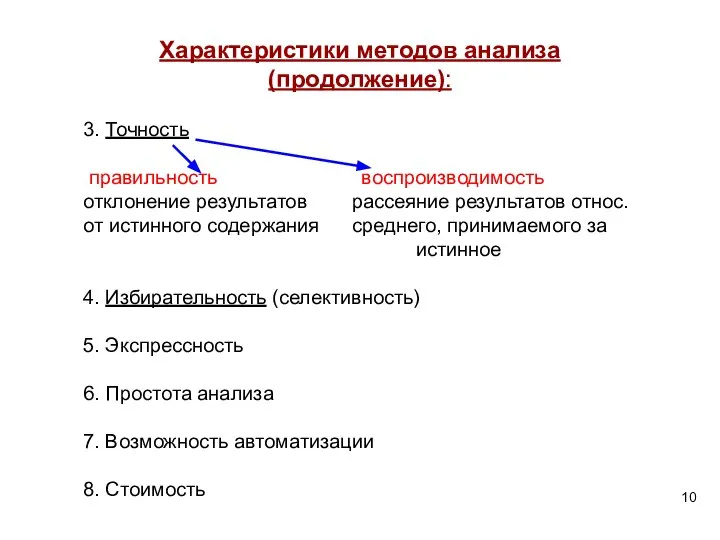
- 10. Характеристики методов анализа (продолжение): 3. Точность правильность воспроизводимость отклонение результатов рассеяние результатов относ. от истинного содержания
- 11. Химические методы растворы cA – общая (аналитическая) концентрация компонента А [A] – равновесная концентрация, т.е. концентрация
- 12. [A]=αAcA α-коэффициент (молярная доля) характеризует глубину протекания конкурирующих реакций 0 раствор Na2CO3 H2CO3 ↔ H+ +
- 13. Если конкурирующие реакции в системе не протекают: cA= [A]; α = 1.
- 14. аА – активность (эффективная, действующая концентрация компонента А), моль/л аА ≤ [A] ≤ cA Мера напряженности
- 15. В реальной системе а) Электростатические взаимодействия – I > 0 EAA ≠ EBB ≠ EAB [A]
- 16. Коэффициенты активности индивидуальных ионов вычисляют по формулам Дебая-Хюккеля (I ≤ 0,01 М) (I = 0,01 –
- 17. б) Химические взаимодействия I > 0, α Компоненты системы могут одновременно участвовать в нескольких равновесиях. Одна
- 18. Химическое равновесие в гомогенной системе При равновесии в химической системе ΔG =0 aA + bB =
- 19. Концентрационные константы равновесий в гомогенной системе K = f (T, P, I) реальная K’ = f
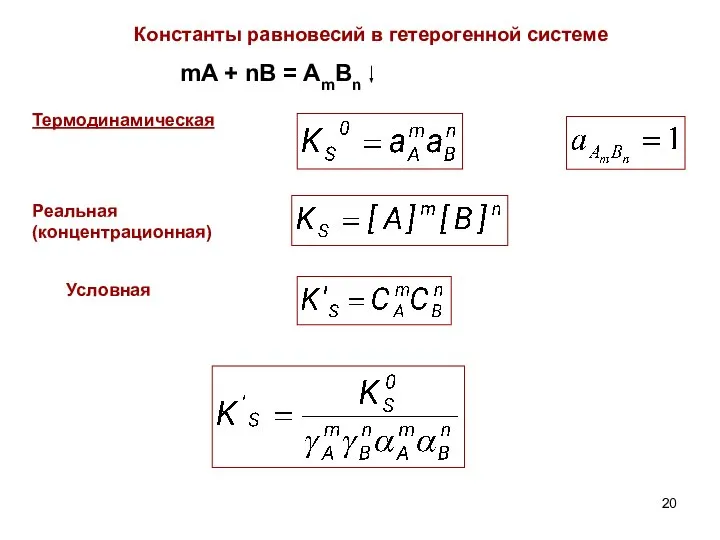
- 20. Константы равновесий в гетерогенной системе mA + nB = AmBn Термодинамическая Реальная (концентрационная) Условная
- 21. Задача: вычислить реальную константу диссоциации Ка,1 для янтарной кислоты НООС-(СН2)2-СООН (НА) в присутствии 0,0164 М раствора
- 22. Титриметрические методы анализа Достоинства: быстрота; универсальность; высокая точность (sr Недостатки: низкая чувствительность. Классические титриметрические методы пригодны
- 23. А + T ↔ продукты Сущность метода титриметрии – о содержании определяемого компонента A судят по
- 24. Процесс добавления реагента T к определяемому компоненту A до тех пор, пока они не прореагируют в
- 25. Требования к реакциям в титриметрии Строгая стехиометричность (только «по одному уравнению») Отсутствие конкурирующих реакций Практически необратимая
- 26. Классификация титриметрических методов По типу реакций, положенных в основу Кислотно-основное титрование HA + B- ↔ HB
- 27. Стандартные растворы Раствор с известной концентрацией называют стандартным раствором Первичные стандартные растворы готовят растворением точного количества
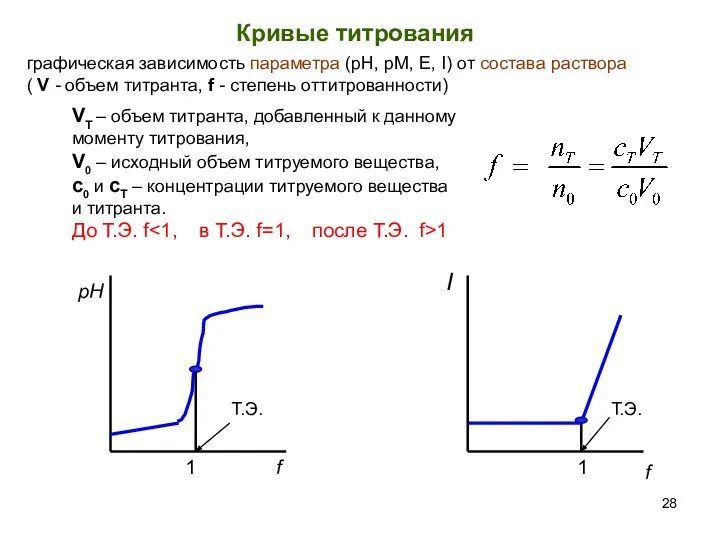
- 28. Кривые титрования графическая зависимость параметра (рН, pM, E, I) от состава раствора ( V - объем
- 29. Закон кратных отношений вещества реагируют между собой в эквивалентных количествах: n1 = n2 aA + bB
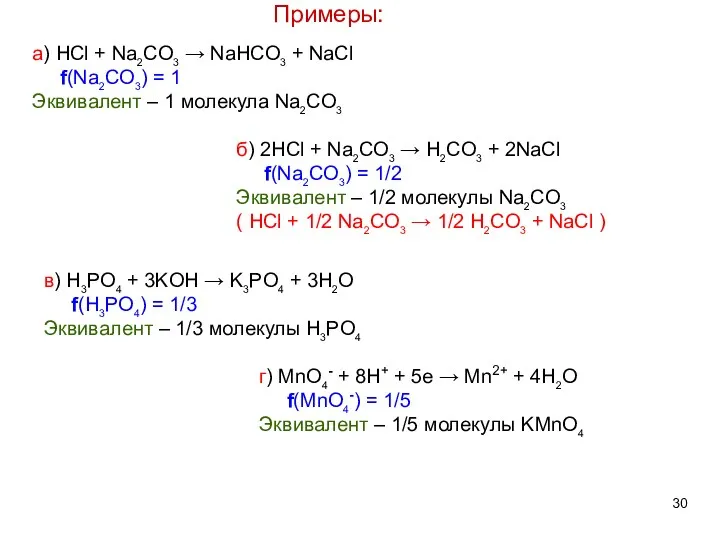
- 30. Примеры: а) HCl + Na2CO3 → NaHCO3 + NaCl f(Na2CO3) = 1 Эквивалент – 1 молекула
- 31. Единица измерения количества вещества (количества частиц) – моль 1 Моль – количество вещества, которое содержит столько
- 33. Скачать презентацию





![Химические методы растворы cA – общая (аналитическая) концентрация компонента А [A] –](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1102307/slide-10.jpg)
![[A]=αAcA α-коэффициент (молярная доля) характеризует глубину протекания конкурирующих реакций 0 раствор Na2CO3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1102307/slide-11.jpg)
![Если конкурирующие реакции в системе не протекают: cA= [A]; α = 1.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1102307/slide-12.jpg)
![аА – активность (эффективная, действующая концентрация компонента А), моль/л аА ≤ [A]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1102307/slide-13.jpg)














 Предельные углеводороды. Алканы, насыщенные углеводороды, парафины, циклоалканы
Предельные углеводороды. Алканы, насыщенные углеводороды, парафины, циклоалканы Презентация на тему Азотная кислота
Презентация на тему Азотная кислота  Алкилкарбон қышқылдарының тұздарын алу
Алкилкарбон қышқылдарының тұздарын алу Приложения для отслеживания проб ALS Geochemistry
Приложения для отслеживания проб ALS Geochemistry Алканы, алкены, алкины
Алканы, алкены, алкины Бензол. Cвойства, реакции, применение
Бензол. Cвойства, реакции, применение Присадки для базовых масел. Присадки и наполнители пластичных смазок
Присадки для базовых масел. Присадки и наполнители пластичных смазок Малотоннажные термопласты
Малотоннажные термопласты Растворы
Растворы Химия – это область чудес
Химия – это область чудес Материалы, изменившие мир
Материалы, изменившие мир Химические свойства производных бензола с непредельного ряда радикалом
Химические свойства производных бензола с непредельного ряда радикалом Карбонильные соединения – альдегиды
Карбонильные соединения – альдегиды Электролиз
Электролиз Атом. Ядро и электронная оболочка
Атом. Ядро и электронная оболочка Основы МКТ
Основы МКТ Кремний и его соединения. Силикатная промышленность
Кремний и его соединения. Силикатная промышленность Генетическая связь между неорганическими соединениями.
Генетическая связь между неорганическими соединениями. Фосфор - светоносный
Фосфор - светоносный Углеводороды в природе
Углеводороды в природе Белки
Белки Стратегия обучения решению задач по химии
Стратегия обучения решению задач по химии Вредна ли губная помада
Вредна ли губная помада Виды лабораторной посуды и её применение в исследовательской работе
Виды лабораторной посуды и её применение в исследовательской работе Гравиметрический анализ. Лекция 1
Гравиметрический анализ. Лекция 1 Приёмы работы с текстом на уроках химии
Приёмы работы с текстом на уроках химии Общая характеристика неметаллов подгруппы кислород
Общая характеристика неметаллов подгруппы кислород Структура периодической таблицы элементов
Структура периодической таблицы элементов