Слайд 2Электролиты
Что такое Электролиты?
Сложный вопрос но для тех кто читал книжку и потратил

немного времени на урок химии тот знает.
Слайд 3Что же это такое?
Электролитическая диссоциация — процесс распада электролита на ионы при его

растворении или плавлении.
Ну или как в книжке.
Слайд 4Диссоциация в растворах
Диссоциация на ионы в растворах происходит вследствие взаимодействия растворённого вещества

с растворителем; по данным спектроскопических методов, это взаимодействие носит в значительной мере химический характер. Наряду с сольватирующей способностью молекул растворителя определённую роль в электролитической диссоциации играет также макроскопическое свойство растворителя — его диэлектрическая проницаемость
Слайд 5Диссоциация при плавлении
Под действием высоких температур ионы кристаллической решётки начинают совершать колебания,

кинетическая энергия повышается, и наступит такой момент (при температуре плавления вещества), когда она превысит энергию взаимодействия ионов. Результатом этого является распад вещества на ионы.
Слайд 6Теория
Классическая теория электролитической диссоциации была создана С. Аррениусом и В. Оствальдом в 1887 году.

Аррениус придерживался физической теории растворов, не учитывал взаимодействие электролита с водой и считал, что в растворах находятся свободные ионы. Русские химики И. А. Каблуков и В. А. Кистяковский применили для объяснения электролитической диссоциации химическую теорию растворов Д. И. Менделеева и доказали, что при растворении электролита происходит его химическое взаимодействие с водой, в результате которого электролит диссоциирует на ионы.
Классическая теория электролитической диссоциации основана на предположении о неполной диссоциации растворённого вещества, характеризуемой степенью диссоциации α, то есть долей распавшихся молекул электролита. Динамическое равновесие между недиссоциированными молекулами и ионами описывается законом действующих масс .
Слайд 7Слабые электролиты
Слабые электролиты — химические соединения, молекулы которых даже в сильно разбавленных растворах

незначительно диссоциированны на ионы, которые находятся в динамическом равновесии с недиссоциированными молекулами. К слабым электролитам относится большинство органических кислот и многие органические основания в водных и неводных растворах.
Слабыми электролитами являются:
почти все органические кислоты и вода;
некоторые неорганические кислоты: HF, HClO, HClO2, HNO2, HCN, H2S, HBrO, H2CO3, H2SiO3, H2SO3 и др.;
некоторые малорастворимые гидроксиды металлов: Fe(OH)3, Zn(OH)2 и др.
Слайд 8Сильные электролиты
Сильные электролиты — химические соединения, молекулы которых в разбавленных растворах практически полностью

диссоциированны на ионы. Степень диссоциации таких электролитов близка к 1. К сильным электролитам относятся многие неорганические соли, некоторые неорганические кислоты и основания в водных растворах, а также в растворителях, обладающих высокой диссоциирующей способностью (спирты, амиды и др.).
Классическая теория электролитической диссоциации применима лишь к разбавленным растворам слабых электролитов. Сильные электролиты в разбавленных растворах диссоциированы практически полностью, поэтому представления о равновесии между ионами и недиссоциированными молекулами лишено смысла. Согласно представлениям, выдвинутым в 20—30-х гг. 20 в. В. К. Семенченко (СССР), Н. Бьеррумом (Дания), Р. М. Фуоссом (США) и др., в растворах сильных электролитов при средних и высоких концентрациях образуются ионные пары и более сложные агрегаты. Современные спектроскопические данные показывают, что ионная пара состоит из двух ионов противоположного знака, находящихся в контакте («контактная ионная пара») или разделённых одной или несколькими молекулами растворителя
Слайд 9Ионные пары электрически нейтральны и не принимают участия в переносе электричества. В

сравнительно разбавленных растворах сильных электролитов равновесие между отдельными сольватированными ионами и ионными парами может быть приближённо охарактеризовано, аналогично классической теории электролитической диссоциации, константой диссоциации (или обратной величиной — константой ассоциации). Это позволяет использовать вышеприведённое уравнение для расчёта соответствующей степени диссоциации, исходя из экспериментальных данных.
В простейших случаях (большие одноатомные однозарядные ионы) приближённые значения константы диссоциации в разбавленных растворах сильных электролитов можно вычислить теоретически, исходя из представлений о чисто электростатическом взаимодействии между ионами в непрерывной среде — растворителе.
Примеры сильных электролитов: некоторые кислоты (HClO4, HMnO4, H2SO4, HCl, HBr; HI), гидроксиды щелочных и щёлочноземельных металлов (NaOH, KOH, Ba(OH)2); большинство солей.








 Коагуляция в дисперсных системах
Коагуляция в дисперсных системах Характеристика 1-й аналитической группы анионов
Характеристика 1-й аналитической группы анионов Электрохимические процессы
Электрохимические процессы Задача 11 Ртутное сердце Команда: Мастера Беспорядка
Задача 11 Ртутное сердце Команда: Мастера Беспорядка Генетические ряды углеводородов. Обобщение и систематизация знаний
Генетические ряды углеводородов. Обобщение и систематизация знаний Презентация на тему Химические свойства металлов
Презентация на тему Химические свойства металлов  Презентация по Химии "Химический БРЕЙН-РИНГ"
Презентация по Химии "Химический БРЕЙН-РИНГ"  Валентность. Валентные возможности атомов
Валентность. Валентные возможности атомов Определение качества дизельного топлива
Определение качества дизельного топлива Комплексные соединения
Комплексные соединения Спирты и фенолы
Спирты и фенолы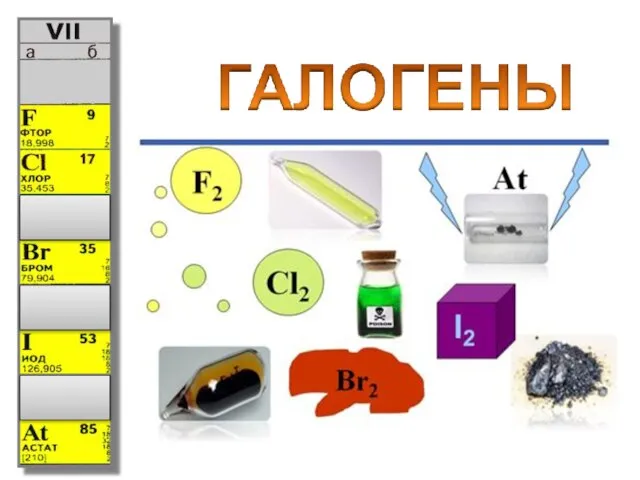 Общая характеристика элементов VIIa группы
Общая характеристика элементов VIIa группы 20141013_dragotsennye_kamni_yuzhnogo_urala
20141013_dragotsennye_kamni_yuzhnogo_urala Нефть
Нефть Ароматические полиамиды (арамиды)
Ароматические полиамиды (арамиды) Презентация на тему Общая характеристика галогенов
Презентация на тему Общая характеристика галогенов  Нагревательные приборы и оборудование лаборатории. Лекция №8
Нагревательные приборы и оборудование лаборатории. Лекция №8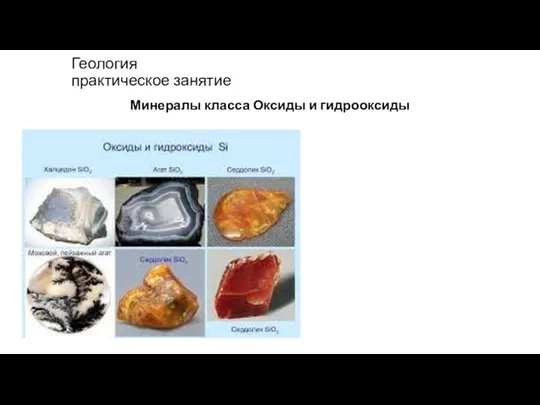 Оксиды и гидрооксиды
Оксиды и гидрооксиды Презентация по Химии "Фиолетовый проказник"
Презентация по Химии "Фиолетовый проказник"  Кинетическая устойчивость комплексов
Кинетическая устойчивость комплексов Определение степеней окисления и расстановка коэффициентов в ОВР
Определение степеней окисления и расстановка коэффициентов в ОВР Электролиз
Электролиз Карбоновые кислоты. Д.И. Менделеев
Карбоновые кислоты. Д.И. Менделеев электролитическая диссоциация
электролитическая диссоциация Таблица Менделеева
Таблица Менделеева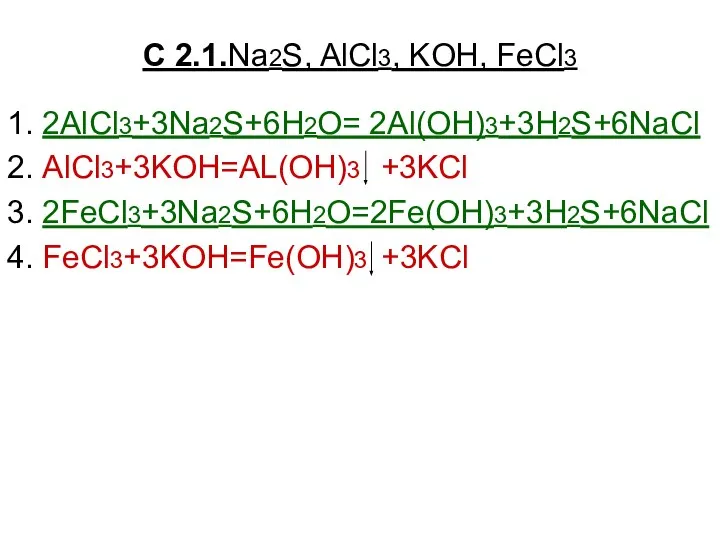 Na2S, AlCl3, KOH, FeCl3
Na2S, AlCl3, KOH, FeCl3 Азот и его соединения
Азот и его соединения Электролитическая диссоциация. 9 класс
Электролитическая диссоциация. 9 класс