т.е. ее энергетический подуровень.
Оно может принимать целочисленные значения от 0 до (n – 1).
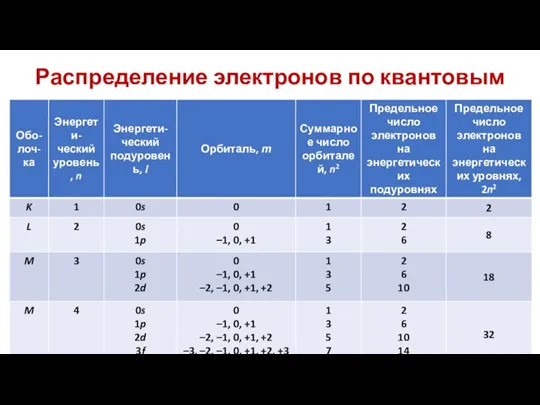
Значения l = 0, 1, 2, 3 соответствуют энергетическим подуровням s, p, d, f.
На 1-м энергетическом уровне имеется один подуровень (s-подуровень), на 2-м - два (s- и p-подуровни), на 3-м – три (s-, p-, d-подуровни), на 4-м – четыре (s-, p-, d-, f-подуровни) и т.д.
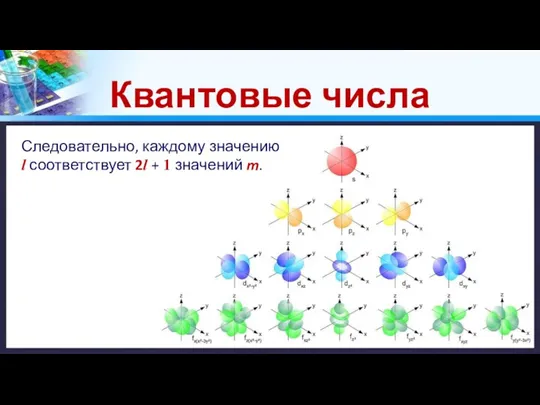
3. Магнитное квантовое число (m) – отражает положение атомной орбитали в пространстве.
Для каждого значения l число m может принимать целочисленные значение от –l до + l , включая 0.







 Төртінші негізгі топша элементтері
Төртінші негізгі топша элементтері Химические свойства оксидов
Химические свойства оксидов Состав атома
Состав атома Структура и функции нуклеиновых кислот
Структура и функции нуклеиновых кислот Экстракция
Экстракция Шаблон для презентации по химии
Шаблон для презентации по химии Презентация по Химии "Алмаз и графит"
Презентация по Химии "Алмаз и графит"  Несовершенства и дефекты кристаллической решетки полимеров
Несовершенства и дефекты кристаллической решетки полимеров Внутренняя среда организма. Система крови. Физико-химические свойства крови
Внутренняя среда организма. Система крови. Физико-химические свойства крови Сера
Сера Соль - без вины виновата
Соль - без вины виновата Zirconium Dioxide
Zirconium Dioxide Спирты
Спирты Problem-solving. Test: real-time polymerase chain reaction
Problem-solving. Test: real-time polymerase chain reaction Кислоты, основания и соли как электролиты
Кислоты, основания и соли как электролиты Степень окисления веществ
Степень окисления веществ Фосфорная кислота и ее свойства
Фосфорная кислота и ее свойства Задача №2 Спящий Амур. Команда гимназии №1 Берлинская лазурь
Задача №2 Спящий Амур. Команда гимназии №1 Берлинская лазурь Металлы в природе. Общие способы их получения
Металлы в природе. Общие способы их получения Удивительное рядом
Удивительное рядом teoriya_elektroliticheskoy_dissotsiatsii
teoriya_elektroliticheskoy_dissotsiatsii Химические реакции
Химические реакции Факторы, влияющие на скорость химических реакций
Факторы, влияющие на скорость химических реакций Классификация неорганических веществ
Классификация неорганических веществ Физические и химические свойства алкенов
Физические и химические свойства алкенов Аттестационная работа. Многогранники: от молекулы до кристалла
Аттестационная работа. Многогранники: от молекулы до кристалла Оценка пригодности природной воды в качестве питьевой по формуле М.Г. Курлова
Оценка пригодности природной воды в качестве питьевой по формуле М.Г. Курлова Окисники, відновники
Окисники, відновники