Содержание
- 2. ЭЛЕКТРОЭНЕРГИЯ В НАШЕЙ ЖИЗНИ
- 3. ГЕНЕРАЦИЯ ЭЛЕКТРОЭНЕРГИИ
- 4. ПОРТАТИВНЫЕ ИСТОЧНИКИ ЭЛЕКТРОЭНЕРГИИ
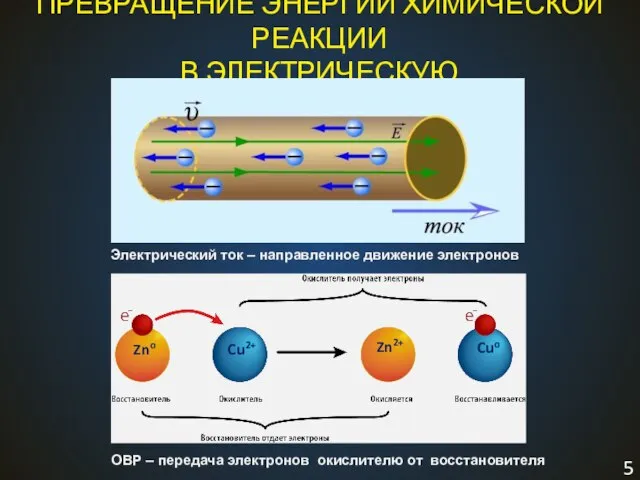
- 5. ПРЕВРАЩЕНИЕ ЭНЕРГИИ ХИМИЧЕСКОЙ РЕАКЦИИ В ЭЛЕКТРИЧЕСКУЮ Электрический ток – направленное движение электронов ОВР – передача электронов
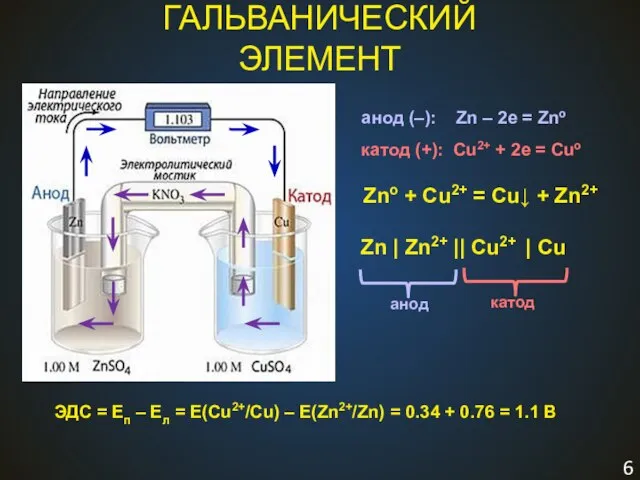
- 6. ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ Zno + Cu2+ = Cu↓ + Zn2+ Zn | Zn2+ || Cu2+ | Cu
- 7. Стандартный водородный электрод (СВЭ) Платиновый электрод, покрытый порошком Pt, в водном растворе кислоты c С(Н+) =
- 8. ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ Анод (окисление): Zn - 2e = Zn2+ Катод (восстановление): 2H+ + 2e = H2
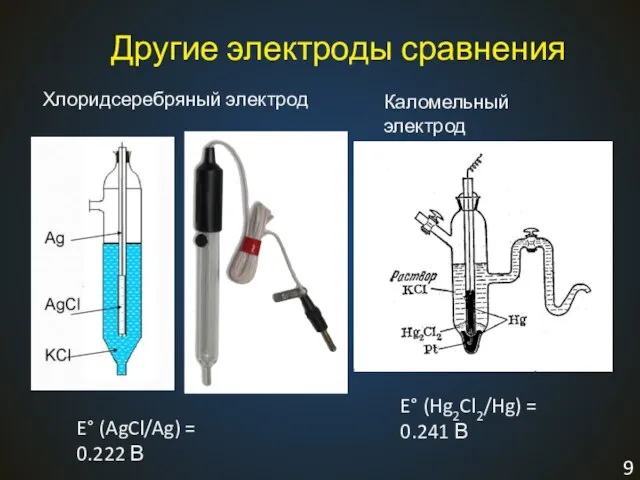
- 9. Другие электроды сравнения Хлоридсеребряный электрод E° (AgCl/Ag) = 0.222 В Электрод II рода AgCl +1ē =
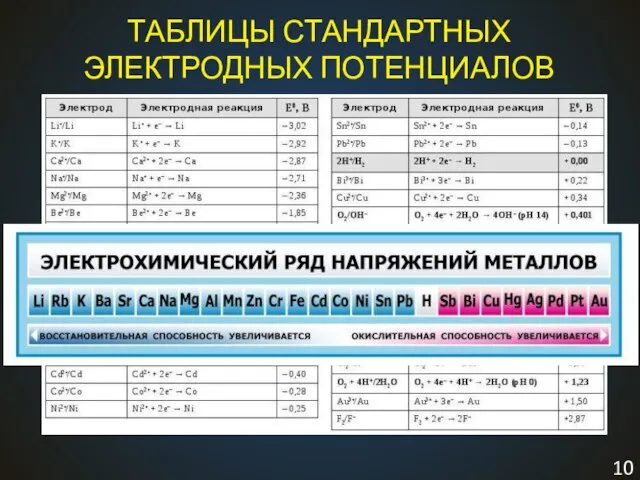
- 10. ТАБЛИЦЫ СТАНДАРТНЫХ ЭЛЕКТРОДНЫХ ПОТЕНЦИАЛОВ Чем выше потенциал, тем сильнее окислитель, чем ниже (отрицательнее) потенциал, тем сильнее
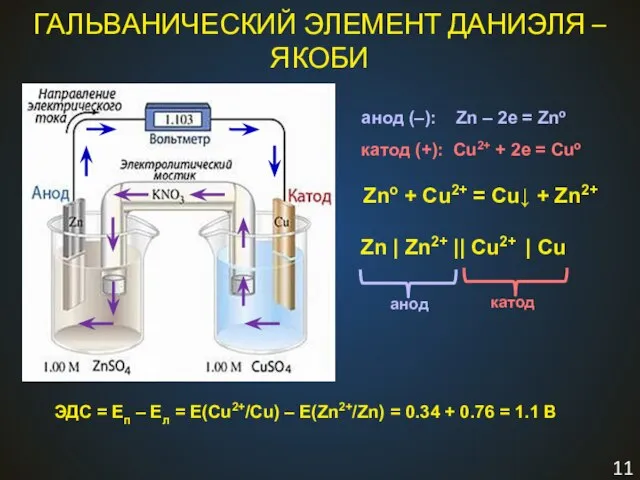
- 11. ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ ДАНИЭЛЯ – ЯКОБИ Zno + Cu2+ = Cu↓ + Zn2+ Zn | Zn2+ ||
- 12. Луиджи Гальвани (1737 – 1798) ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ ДАНИЭЛЯ – ЯКОБИ Алессандро Вольта (1745 – 1827) Вольтов
- 13. ДРЕВНИЙ ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ ? «Багдадская батарейка» (~ III в. до н.э.)
- 15. МАРГАНЕЦ-ЦИНКОВЫЙ ЭЛЕМЕНТ (элемент Лекланше, солевой элемент) Анод: Zn – 2e− → Zn2+ Катод: 2MnO2 + 2H3O+
- 16. ЩЕЛОЧНОЙ ЭЛЕМЕНТ Анод: Zn + 2OH− → Zn(OH)2 + 2ē Катод: 2MnO2 + H2O + 2ē
- 17. ЭЛЕКТРИЧЕСКИЕ АККУМУЛЯТОРЫ Электрический аккумулятор — химический источник тока многоразового действия. Разряжение: как гальванический элемент (источник тока)
- 18. СВИНЦОВО-КИСЛОТНЫЙ АККУМУЛЯТОР Pb | H2SO4 | PbO2, Pb анод (–): Pb + SO42- – 2е =
- 19. Никель-кадмиевый аккумулятор Ni(OH)2/Fe Cd(OH)2/Fe Электролит: KOH Заряжение: анод (+): Ni(OH)2 + OH- – 1е = NiO(OH)
- 20. Никель-металлгидридный аккумулятор Заряжение: анод (+): Ni(OH)2 + OH- – 1е = NiO(OH) + H2O катод (–):
- 21. Майкл Стэнли Уиттингем (1941 г.., Великобритания) Джон Гуденаф (1922 г.., США) Акиро Ёсина (1922 г.., США)
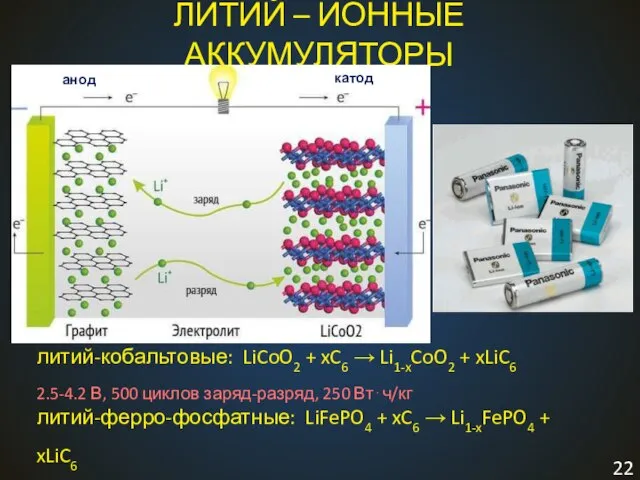
- 22. литий-кобальтовые: LiCoO2 + xC6 → Li1-xCoO2 + xLiC6 2.5-4.2 В, 500 циклов заряд-разряд, 250 Вт⋅ч/кг литий-ферро-фосфатные:
- 24. Скачать презентацию















 Протолитические буферные системы. Буферные системы организма, их взаимодействие
Протолитические буферные системы. Буферные системы организма, их взаимодействие Классификация органических веществ Химия. 10 класс Абрамова С.И.
Классификация органических веществ Химия. 10 класс Абрамова С.И. Биотит и тальк
Биотит и тальк Принципы строения молекулы дезоксирибонуклеиновой кислоты: комплементарность нуклеотидов
Принципы строения молекулы дезоксирибонуклеиновой кислоты: комплементарность нуклеотидов Кислоты. К уроку по химии для 8 класса
Кислоты. К уроку по химии для 8 класса Коррозия металлов и способы борьбы с ней
Коррозия металлов и способы борьбы с ней Металлическая химическая связь
Металлическая химическая связь Алхимики в Средние века
Алхимики в Средние века Фотометрический анализ
Фотометрический анализ Элементы, названные в честь исследователей
Элементы, названные в честь исследователей Презентация по Химии "Металлы в организме человека"
Презентация по Химии "Металлы в организме человека" 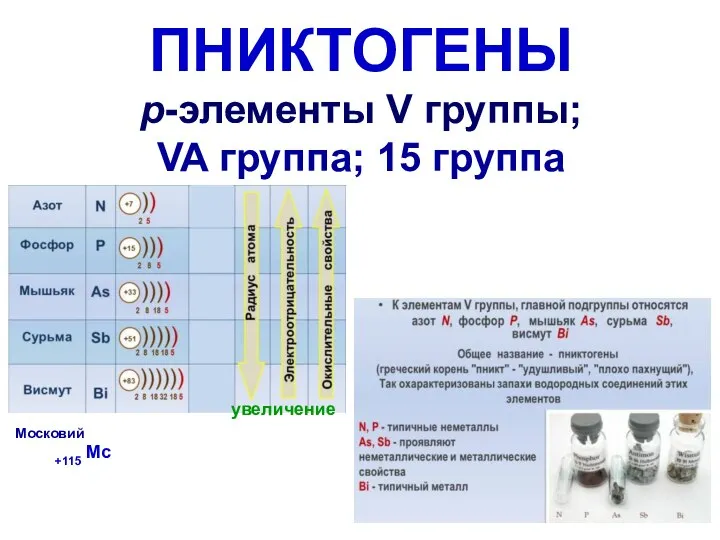 Пниктогены р-элементы V группы; VA группа; 15 группа
Пниктогены р-элементы V группы; VA группа; 15 группа Из опыта использования интерактивной доски на уроках химии
Из опыта использования интерактивной доски на уроках химии Индикаторная бумага
Индикаторная бумага Определение количества этилендиамина в соединении [Gd(en)x][Fe(CN)6]
Определение количества этилендиамина в соединении [Gd(en)x][Fe(CN)6] Нитраты
Нитраты Донорно-акцепторный механизм образование связи
Донорно-акцепторный механизм образование связи Вода – самое удивительное вещество на Земле
Вода – самое удивительное вещество на Земле Серная кислота и её соли. Качественная реакция на сульфат-ион
Серная кислота и её соли. Качественная реакция на сульфат-ион Плотность веществ. Задачи
Плотность веществ. Задачи Счастливый случай
Счастливый случай Аналитическая химия
Аналитическая химия Розчинність речовин, її залежність від різних чинників
Розчинність речовин, її залежність від різних чинників Альдегиды и кетоны
Альдегиды и кетоны Х 9 Урок 7 Электролитическая диссоциация
Х 9 Урок 7 Электролитическая диссоциация Сероводород, сульфиды
Сероводород, сульфиды Генетическая связь веществ. Виды реакций
Генетическая связь веществ. Виды реакций Классификация спиртов
Классификация спиртов