Содержание
- 2. Магнитный момент атома. Периодическая система элементов Д.И. Менделеева Магнитный момент атома. Опыт Штерна и Герлаха. Спин
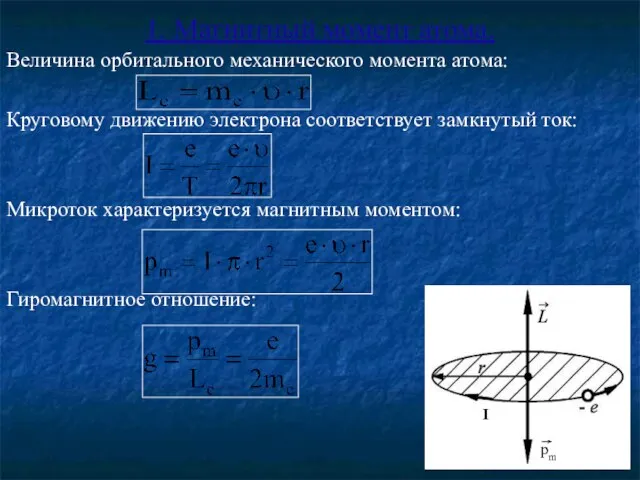
- 3. 1. Магнитный момент атома. Величина орбитального механического момента атома: Круговому движению электрона соответствует замкнутый ток: Микроток
- 4. Т.о. в любом квантовом состоянии атом обладает, кроме механического, магнитным моментом: μБ – магнетон Бора –
- 5. формула пространственного квантования - определяет возможные дискретные расположения электронных орбит в пространстве по отношению к направлению
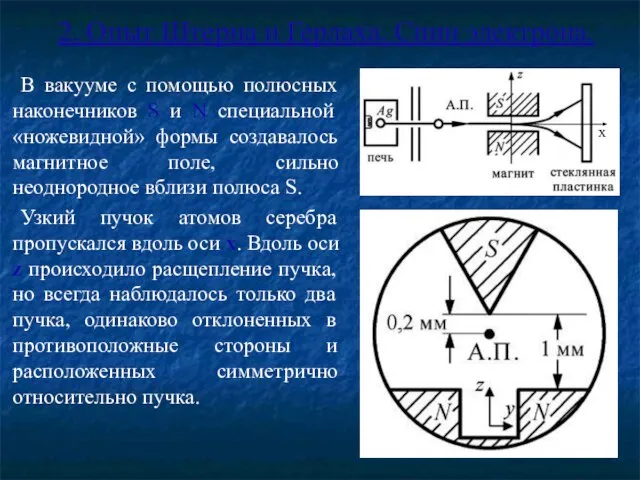
- 6. 2. Опыт Штерна и Герлаха. Спин электрона. В вакууме с помощью полюсных наконечников S и N
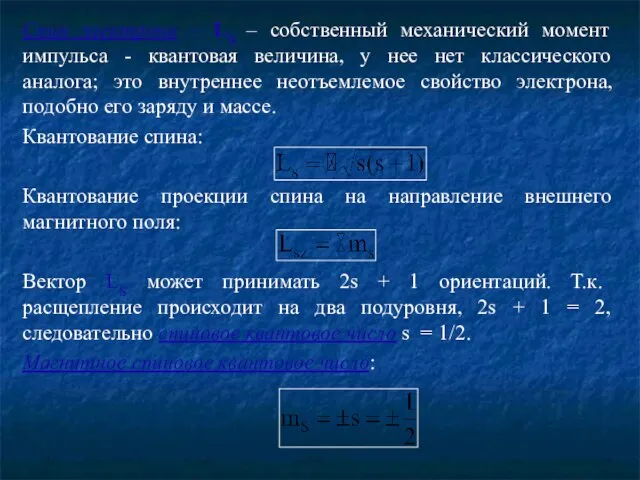
- 7. Спин электрона – LS – cобственный механический момент импульса - квантовая величина, у нее нет классического
- 8. Собственный (спиновый) магнитный момент: Гиромагнитное отношение для спиновых моментов:
- 9. 3. Распределение электронов по энергетическим уровням в атоме. Принцип Паули. Электронная оболочка и подоболочка. Состояние электрона
- 10. Принцип Паули: В одном а томе не может быть более одного электрона с одинаковым набором четырех
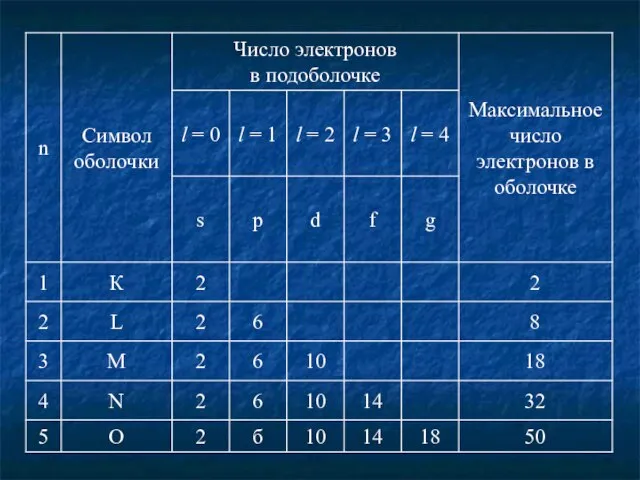
- 11. Распределение электронов по оболочкам и подоболочкам. Максимальное число электронов в состоянии, определяемом главным квантовым числом n:
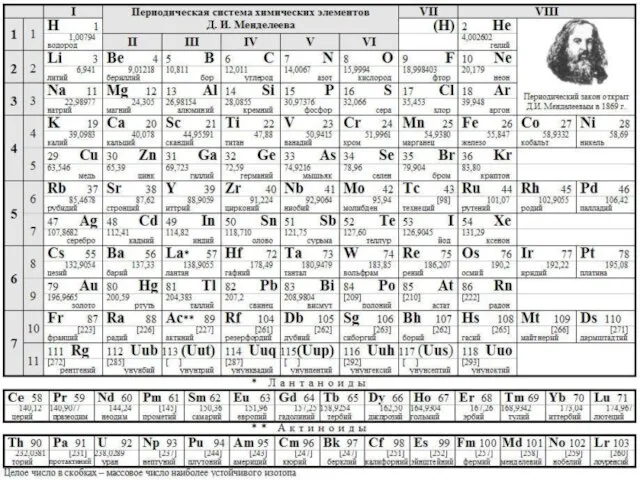
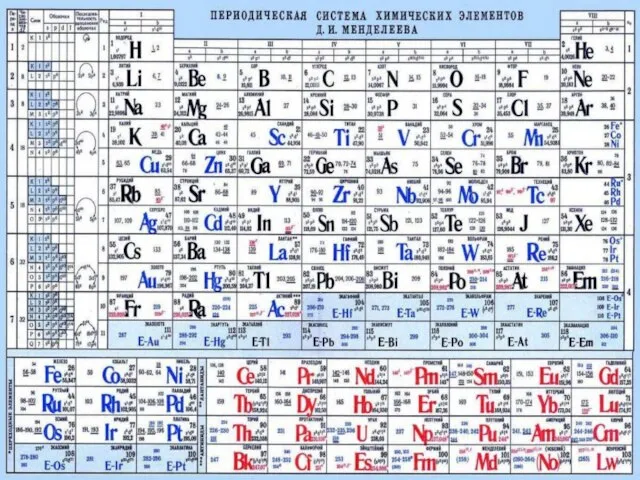
- 13. 4. Периодическая система элементов Д.И.Менделеева.
- 14. 5. Периодическая система элементов Д.И.Менделеева.
- 17. Скачать презентацию








 Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Приёмы работы с текстом на уроках химии
Приёмы работы с текстом на уроках химии Соли (8 класс)
Соли (8 класс) Степень окисления
Степень окисления Основные понятия и представления о химии. Тела и среды. Представление о системах
Основные понятия и представления о химии. Тела и среды. Представление о системах Презентация по Химии "Токсическое действие неорганических веществ"
Презентация по Химии "Токсическое действие неорганических веществ"  8-11 2 валентность
8-11 2 валентность Лекция1Тов
Лекция1Тов Водневий та металічний звязок
Водневий та металічний звязок Среды для культивирования эмбрионов-история разработки и составы
Среды для культивирования эмбрионов-история разработки и составы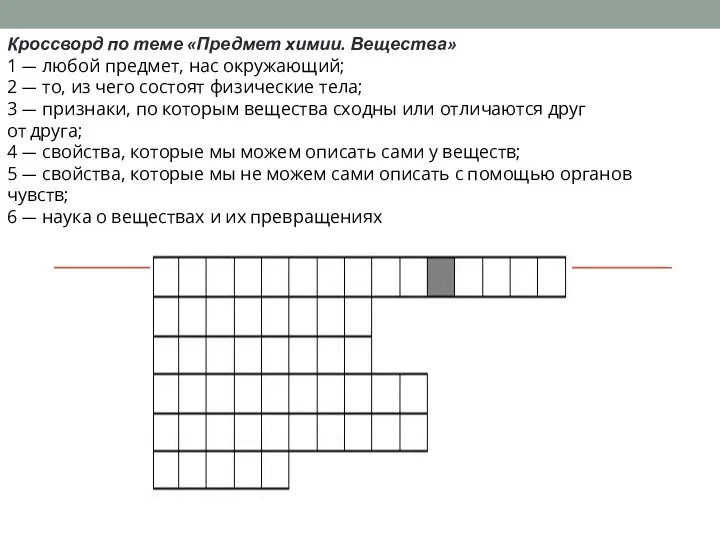 Предмет химии. Вещества
Предмет химии. Вещества Металлы в природе. Общие способы их получения
Металлы в природе. Общие способы их получения Графен. Нобелевская премия 2016
Графен. Нобелевская премия 2016 Щелочноземельные металлы
Щелочноземельные металлы Применение неорганических соединений в пищевой промышленности
Применение неорганических соединений в пищевой промышленности История гипса
История гипса Закон сохранения массы веществ
Закон сохранения массы веществ Нефть и способы её переработки
Нефть и способы её переработки Валентность (7 класс)
Валентность (7 класс) Неметаллы
Неметаллы Тренажер. Типы химических реакций
Тренажер. Типы химических реакций Химические явления
Химические явления Основы химической термодинамики и термохимии. Лекция 5
Основы химической термодинамики и термохимии. Лекция 5 Висмут
Висмут Ministry of Education and Science of the Russian Federation
Ministry of Education and Science of the Russian Federation Химическая связь 11 класс - Презентация_
Химическая связь 11 класс - Презентация_ Леция 1. Природа сил взаимодействия. Методы исследования комплексообразования:
Леция 1. Природа сил взаимодействия. Методы исследования комплексообразования: Электролиз
Электролиз