Содержание
- 2. HSO3− H+ + SO32− Кислоты – электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного
- 3. Основания – электролиты, которые при диссоциации образуют катионы металла и анионы гидроксогрупп ОН- NaOH = Na+
- 4. Средние соли – сильные электролиты, которые при диссоциации образуют катионы металла (или аммония NH4+) и анионы
- 6. Скачать презентацию
Слайд 2HSO3− H+ + SO32−
Кислоты – электролиты, которые при диссоциации образуют катионы водорода
HSO3− H+ + SO32−
Кислоты – электролиты, которые при диссоциации образуют катионы водорода

HNO3 H+ + NO3−
H2SO4 2H+ + SO42−
Общие характерные свойства кислот обусловлены присутствием катионов водорода
Слабые многоосновные кислоты диссоциируют ступенчато:
H2SO3 H+ + HSO3−
HCl H+ + Cl-
Слайд 3Основания – электролиты, которые при диссоциации образуют катионы металла и анионы гидроксогрупп
Основания – электролиты, которые при диссоциации образуют катионы металла и анионы гидроксогрупп

NaOH = Na+ + OH-
КОН = К+ + ОН-
Са(ОН)2 = Са2+ + 2ОН-
Общие свойства оснований обусловлены присутствием гидроксид-ионов ОН-
Слабые многокислотные основания диссоциируют ступенчато.
Fe(OH)2 FeOH+ + OH-
1 ступень
2 ступень
FeOH+ Fe2+ + OH-
Слайд 4Средние соли – сильные электролиты, которые при диссоциации образуют катионы металла (или
Средние соли – сильные электролиты, которые при диссоциации образуют катионы металла (или

К3РО4 3К+ + РО43-
NH4Cl NH4+ + Cl−
Кислые соли – электролиты, диссоциирующие на катион металла и сложный анион, в состав которого входят атомы водорода и кислотный остаток
NaHCO3 Na+ + HCO3−
Основные соли – электролиты, которые при диссоциации образуют анионы кислотного остатка и сложные катионы, состоящие из атомов металла и гидроксогрупп ОН−
(FeOH)2SO4 2FeOH+ + SO42−
α1 >> α2
α1 >> α2
HCO3− H+ + CO32−
FeOH+ Fe2+ + OH−
 Неорганическая и органическая химия
Неорганическая и органическая химия Химические явления
Химические явления Строение и физические свойства металлов
Строение и физические свойства металлов Презентация на тему Электрохимический ряд напряжений металлов
Презентация на тему Электрохимический ряд напряжений металлов  Кинетика химических и биохимических процессов. Часть 1
Кинетика химических и биохимических процессов. Часть 1 Общая характеристика металлов
Общая характеристика металлов Prezentatsia_lektsia_Reaktora_2_Materialny_balans
Prezentatsia_lektsia_Reaktora_2_Materialny_balans Химия. Электролитическая диссоциация. (9 класс)
Химия. Электролитическая диссоциация. (9 класс)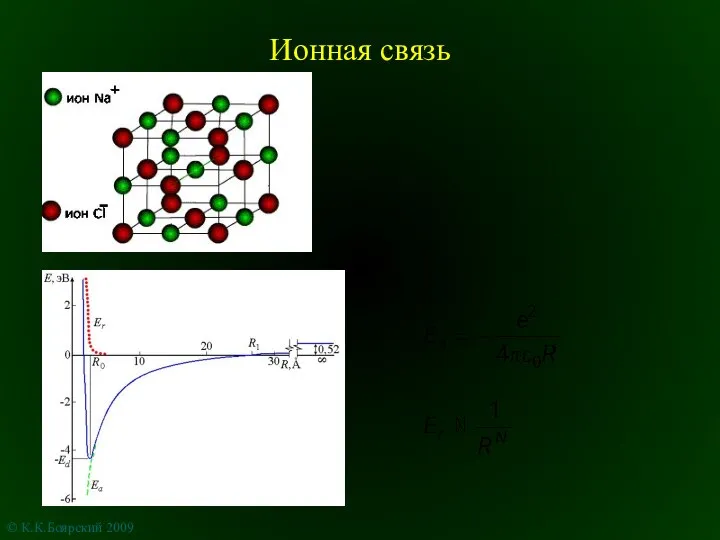 Ионная связь
Ионная связь Образовательные технологии, используемые на уроках химии для повышения мотивации обучения
Образовательные технологии, используемые на уроках химии для повышения мотивации обучения Что такое электрон?
Что такое электрон? Практическая работа 1. ХТП. Классификация химических реакций
Практическая работа 1. ХТП. Классификация химических реакций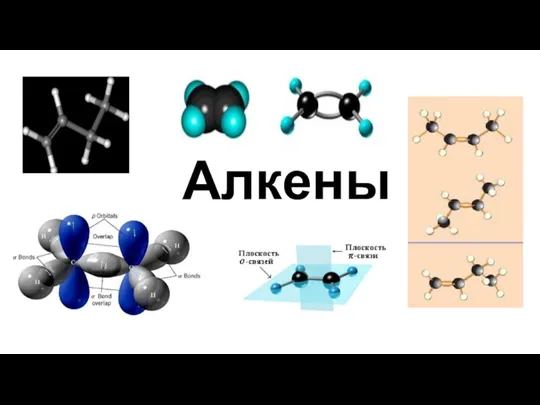 Алкены. Гомологический ряд алкенов. Изомерия алкенов. Химические свойства алкенов
Алкены. Гомологический ряд алкенов. Изомерия алкенов. Химические свойства алкенов Презентация на тему Привычная и удивительная поваренная соль
Презентация на тему Привычная и удивительная поваренная соль  Презентация1
Презентация1 Будова електронних оболонок і властивості хіиічних елементів. (8 клас)
Будова електронних оболонок і властивості хіиічних елементів. (8 клас) Спирты и их производные
Спирты и их производные Турнир смекалистых. Все о кислотах
Турнир смекалистых. Все о кислотах Номенклатура алканов разветвленного строения
Номенклатура алканов разветвленного строения Теория химического строения А. М. Бутлерова
Теория химического строения А. М. Бутлерова Предельные углеводороды. Алканы, насыщенные углеводороды, парафины, циклоалканы
Предельные углеводороды. Алканы, насыщенные углеводороды, парафины, циклоалканы Классификация загрязняющих веществ по фазово-дисперсному составу
Классификация загрязняющих веществ по фазово-дисперсному составу ТЕМА: БОЛЬШОЙ КРУГОВОРОТ ВЕЩЕСТВ
ТЕМА: БОЛЬШОЙ КРУГОВОРОТ ВЕЩЕСТВ Свойства воды
Свойства воды Массообменные процессы
Массообменные процессы Солевые кристаллы
Солевые кристаллы Оксиды. Физические свойства
Оксиды. Физические свойства Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота
Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота