Содержание
- 2. План: Определение и классификация Свойства коллойдно-дисперсных систем Способы получения и методы очистки коллоидных растворов Устойчивость коллоидных
- 3. Дисперсными называются системы, состоящие из множества малых частиц, равномерно распределенных в жидкой, твердой и газообразной среде.
- 4. Высокая дисперсность придает веществам новые качественные признаки: Повышенная реакционная способность; Интенсивное окрашивание и светорассеивание; Большой запас
- 5. Классификация дисперсных систем По размеру частиц дисперсной фазы (или по степени дисперсности) Д = 1 /
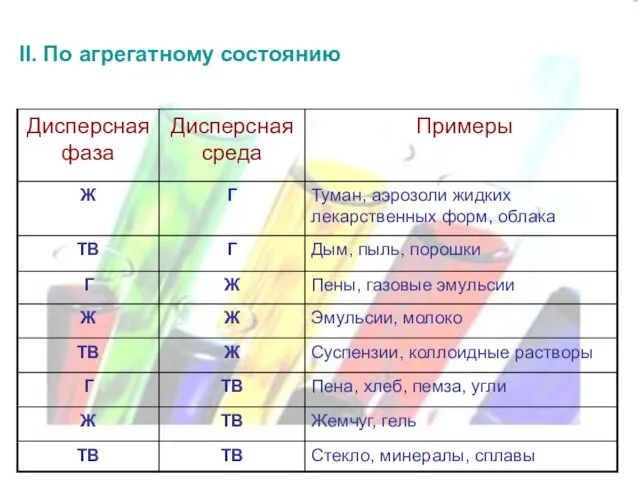
- 6. II. По агрегатному состоянию
- 7. III. По отношению к дисперсионной среде а) свободно-дисперсные (аэрозоли, суспензии, эмульсии); б) связно-дисперсные (гели, студни, пены);
- 8. Для коллоидно-дисперсных систем характерны свойства Молекулярно-кинетические Это броуновское движение, диффузия, осмотическое давление А. Эйнштейн и М.
- 9. Чем крупнее частица дисперсной фазы, тем меньше величина ее смещения. С увеличением размера частиц прекращается поступательное
- 10. Осмос менее характерен коллоидным растворам, чем истинным. Значение осмоса велико в физиологических процессах, т.к в любом
- 11. II. Оптические Это рассеяние света, поглощение света. Явления – отражение, преломление, рассеяние и поглощение – зависят
- 12. Д. Рэлей дал уравнение J0 – интенсивность падающего света; Jр – интенсивность рассеянного света; λ -
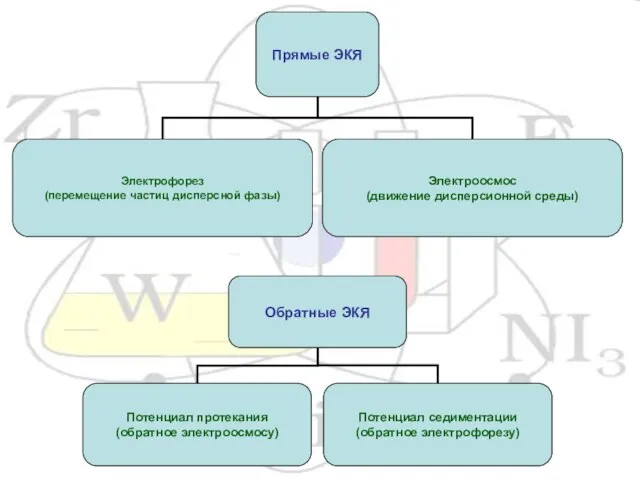
- 13. III. Электрокинетические Коллоидная частица состоит из мицелл и интермицеллярной жидкости. Строение мицеллы на примере йодида серебра.
- 14. Двойной электрический слой (ДЭС) возникает на границе твердое тело – жидкость за счет избирательной адсорбции ионов
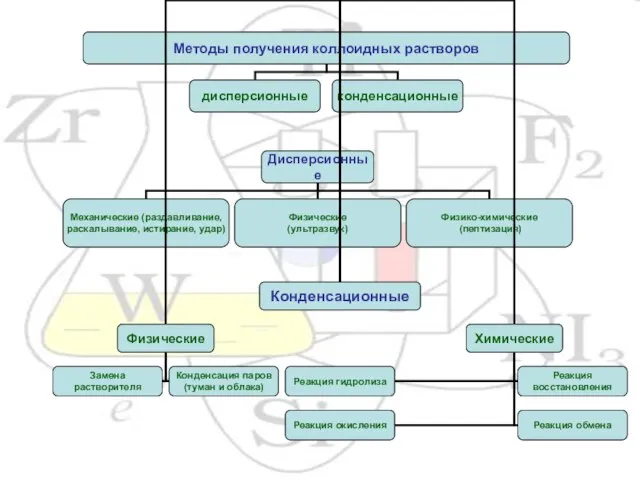
- 17. Примеры FeCl3 + 3H2O ↔ Fe(OH)3 + 3HCl H2S + 0,5O2 → S + H2O 2KAuO2
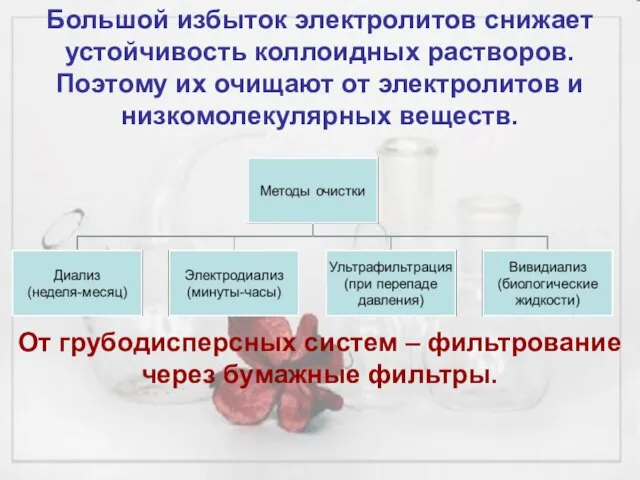
- 18. Большой избыток электролитов снижает устойчивость коллоидных растворов. Поэтому их очищают от электролитов и низкомолекулярных веществ. От
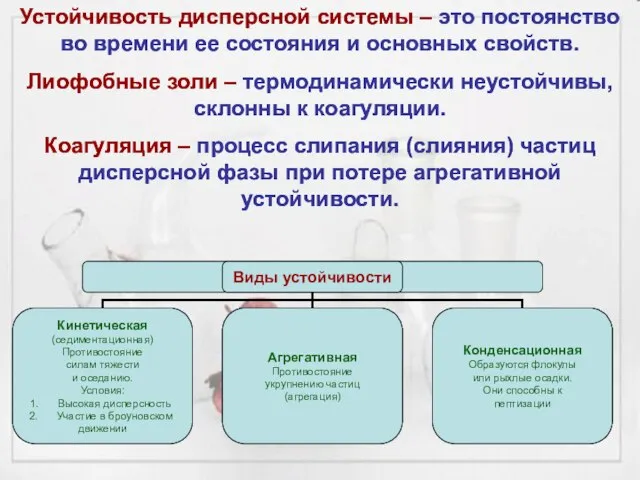
- 19. Устойчивость дисперсной системы – это постоянство во времени ее состояния и основных свойств. Лиофобные золи –
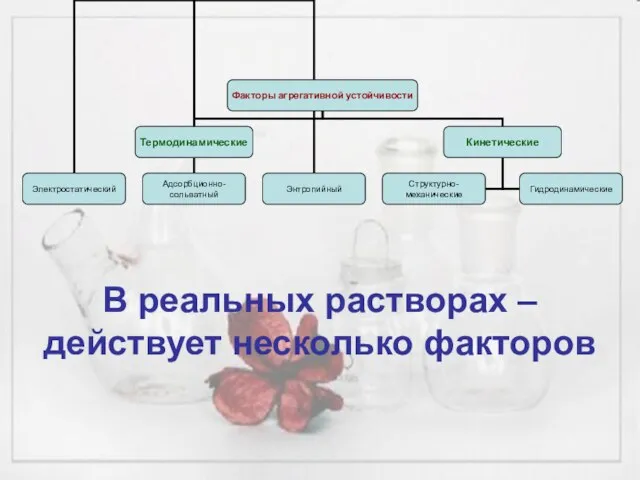
- 20. В реальных растворах – действует несколько факторов
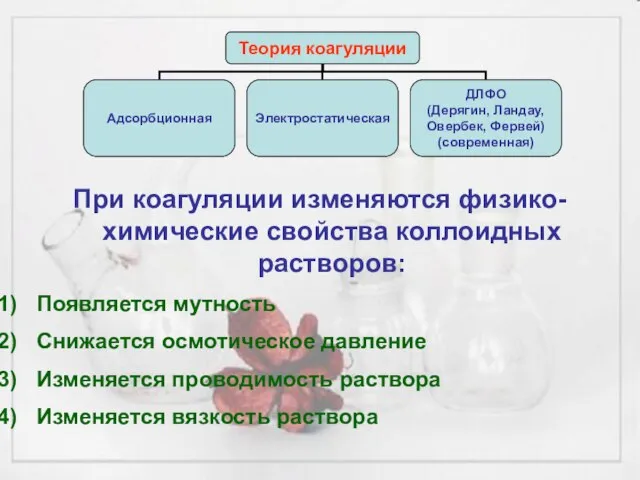
- 21. При коагуляции изменяются физико-химические свойства коллоидных растворов: Появляется мутность Снижается осмотическое давление Изменяется проводимость раствора Изменяется
- 22. Наиболее важный фактор – действие электролитов. Они быстро и резко влияют на толщину двойного электрического слоя.
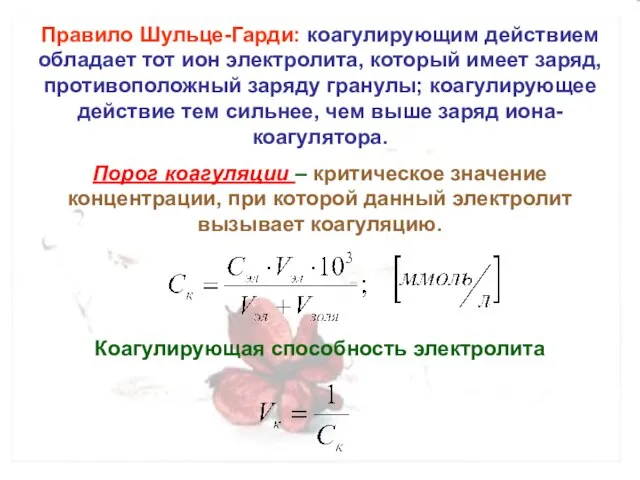
- 23. Правило Шульце-Гарди: коагулирующим действием обладает тот ион электролита, который имеет заряд, противоположный заряду гранулы; коагулирующее действие
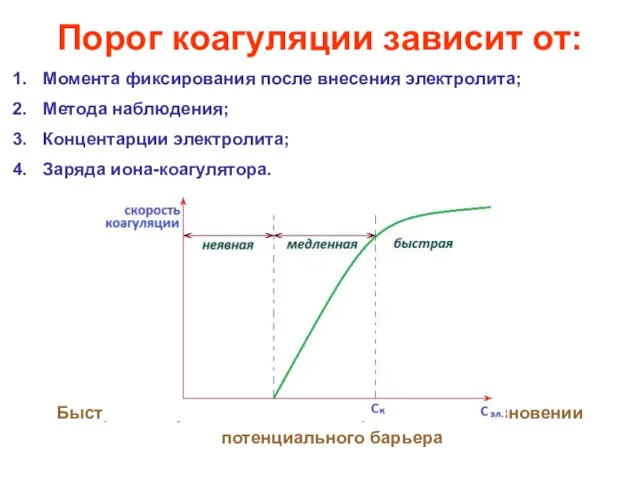
- 24. Порог коагуляции зависит от: Момента фиксирования после внесения электролита; Метода наблюдения; Концентарции электролита; Заряда иона-коагулятора. Быстрая
- 25. По теории ДЛФО – 2 основных механизма: 1. концентрационная коагуляция за счет неэлектролитов; 2. нейтрализационная коагуляция
- 27. Скачать презентацию















 Презентация по Химии "Законы газового состояния вещества"
Презентация по Химии "Законы газового состояния вещества"  Нуклеиновые кислоты
Нуклеиновые кислоты ТЭЦ, работающие на каменном угле более экологичны, чем на буром. Факт или вымысел?
ТЭЦ, работающие на каменном угле более экологичны, чем на буром. Факт или вымысел? Масляная кислота
Масляная кислота Азотосодержащие органические соединения
Азотосодержащие органические соединения Железо
Железо Башня плотности
Башня плотности Метаболизм липидов
Метаболизм липидов Презентация на тему Полисахариды. Крахмал и целюлоза
Презентация на тему Полисахариды. Крахмал и целюлоза  Потенциометрические анализаторы Поверка рН - метра
Потенциометрические анализаторы Поверка рН - метра Пересчет данных анализа, выраженных в ионной форме
Пересчет данных анализа, выраженных в ионной форме Синтез латексов
Синтез латексов Сухой спирт
Сухой спирт Презентация на тему Химические свойства оксидов
Презентация на тему Химические свойства оксидов  Бор и его соединения
Бор и его соединения Химическая кинетика. Экзаменационные вопросы
Химическая кинетика. Экзаменационные вопросы Строение электронных оболочек атома
Строение электронных оболочек атома Фосфор, строение, свойства
Фосфор, строение, свойства Биологически важные реакции монофункциональных соединений. Реакционная способность спиртов, фенолов, тиолов, аминов
Биологически важные реакции монофункциональных соединений. Реакционная способность спиртов, фенолов, тиолов, аминов Строение вещества
Строение вещества Номенклатура и изомерия аренов
Номенклатура и изомерия аренов Свойства аминов
Свойства аминов Презентация на тему Cкорость химических реакций
Презентация на тему Cкорость химических реакций  Строение и свойства этилена
Строение и свойства этилена Химические сплавы Cu
Химические сплавы Cu Group 6 Cations
Group 6 Cations ТЕСТ "Дисперсные системы"
ТЕСТ "Дисперсные системы" Презентация на тему Щелочные металлы
Презентация на тему Щелочные металлы