Содержание
- 2. Содержание ЭДМ Введение. Требования ГОС. Цели занятия. Электролиты. Неэлектролиты С.Аррениус-основоположник теории электролитической диссоциации Основные положения электролитической
- 3. Содержание ЭДМ 13. Диссоциация кислот 14. Диссоциация оснований 15. Диссоциация амфотерных гидроксидов 16. Диссоциация солей 17.Электролитическая
- 4. Введение Электронный дидактический материал на тему: «Теория электролитической диссоциации. Протолитическая теория кислот и оснований» предназначен для
- 5. Требования ГОС к уровню подготовки специалистов в области химии для специальности «Лабораторная диагностика» После изучения темы
- 6. Цели занятия Учебная: добиться прочного усвоения системы знаний, формирование практических умений и навыков. Развивающая: формирование навыков
- 7. Электролиты. Неэлектролиты Водные растворы солей, кислот и оснований проводят электрический ток. Аналогично ведут себя расплавы солей
- 8. Электролиты. Неэлектролиты По способности проводить электрический ток в водном растворе или в расплаве все вещества можно
- 9. Электролиты. Неэлектролиты К электролитам относятся соли, кислоты и основания. В молекулах этих веществ имеются ионные или
- 10. Неэлектролитами называют вещества, водные растворы или расплавы которых не проводят электрический ток. К неэлектролитам относятся, например,
- 11. В 1887г. Шведский учёный С.Аррениус для объяснения особенностей водных растворов веществ предложил теорию электролитической диссоциации. В
- 12. Основные положения электролитической диссоциации 1.Молекулы электролитов при растворении в воде или расплавлении распадаются на ионы. Процесс
- 13. Основные положения электролитической диссоциации Ионы — это атомы или группы атомов, имеющие положительный или отрицательный заряд.
- 14. Основные положения электролитической диссоциации 2. В растворе или расплаве электролитов ионы движутся хаотически. При пропускании через
- 15. Основные положения электролитической диссоциации Положительные ионы называются катионами, отрицательные ионы-анионами. К катионам относятся ион водорода Н+,
- 16. Диссоциация многих электролитов —процесс обратимый. Это значит, что одновременно идут два противоположных процесса: распад молекул на
- 17. Основные положения электролитической диссоциации Диссоциацию молекул электролитов выражают уравнениями, в которых ставят знак обратимости ( ).
- 18. Основные положения электролитической диссоциации Уравнение диссоциации азотистой кислоты HNO2 записывается таким образом: ионизация (диссоциация) НNO2 H+
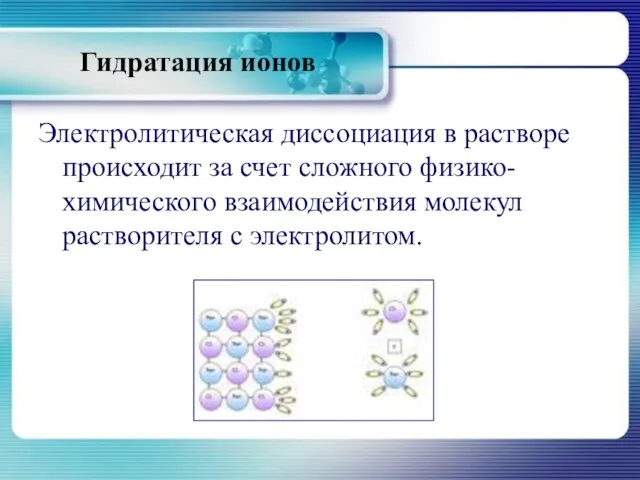
- 19. Гидратация ионов Электролитическая диссоциация в растворе происходит за счет сложного физико-химического взаимодействия молекул растворителя с электролитом.
- 20. Гидратация ионов Согласно химической теории растворов Д.И. Менделеева, при растворении веществ в воде происходит химическое взаимодействие
- 21. Гидратация ионов В результате взаимодействия растворенного вещества с молекулами воды образуются химические соединения -гидраты. И.А. Каблуков
- 22. Механизм электролитической диссоциации. I. Диссоциация электролитов с ионной связью. При растворении в воде ионных соединений, например,
- 23. Между ионами электролита и диполями воды возникают силы взаимного притяжения, которые оказываются прочнее межионных связей в
- 24. При растворении в воде веществ НС1 происходит ориентация диполей воды и возникают междипольные связи. В результате
- 25. Связь в молекуле электролита становится более полярной, а затем превращается в ионную. Эта связь легко разрывается
- 26. Степень диссоциации (ионизации) В водных растворах некоторые электролиты полностью распадаются на ионы. Другие электролиты распадаются на
- 27. Степень диссоциации (ионизации) Для количественной характеристики соотношения диссоциированных и недиссоциированных молекул электролита используют понятие «степень электролитической
- 28. Степень диссоциации (ионизации) Степень электролитической диссоциации равна отношению числа молекул, которые распались на ионы, к общему
- 29. Степень диссоциации (ионизации) Степень диссоциации зависит от природы растворителя и природы растворенного вещества. Одно и то
- 30. Степень диссоциации (ионизации) Молекулы серной кислоты H2SO4 хорошо диссоциируют в воде, слабее в этаноле и совсем
- 31. Сильные электролиты — это такие электролиты, для которых степень диссоциации в водных растворах равна 1 (100%).
- 32. Слабые электролиты — это такие электролиты, для которых степень диссоциации в водных растворах меньше 1 (100%).
- 33. К слабым электролитам относятся: 1. Слабые кислоты - НС1О2, НС1О, HNO2, H2CO3, H2SiО3, H3PO4, HF, H3BO3;
- 34. Принадлежность вещества к сильным и слабым электролитам нельзя связывать с его растворимостью. Например, хлорид серебра AgCl
- 35. Газ аммиак NH3 очень хорошо растворяется в воде, но только часть молекул NH3 взаимодействуют с водой
- 36. Степень ионизации электролита зависит от его концентрации в растворе. Разбавление раствора ведет к повышению степени диссоциации
- 37. Степень ионизации зависит и от изменения температуры раствора электролита. При повышении температуры степень диссоциации электролита увеличивается.
- 38. С повышением температуры энергия молекул увеличивается, химическая связь в них ослабляется, что облегчает процесс диссоциации электролитов,
- 39. На степень диссоциации влияет добавление одноименных ионов к раствору слабого электролита. Например, если к раствору уксусной
- 40. Константа диссоциации (ионизации) Для количественной характеристики слабых электролитов применяют константу диссоциации (К). Любая обратимая реакция характеризуется
- 41. Для слабого электролита общей формулы: AnBm AnBm пАm+ + mBn- согласно закону действия масс, в состоянии
- 42. Величина константы ионизации характеризует способность электролита диссоциировать на ионы. Чем больше константа диссоциации, тем больше ионов
- 43. Из значений констант диссоциации этих кислот видно, что уксусная кислота приблизительно в 30 000 раз сильнее
- 44. Для любой концентрации раствора электролита величина константы ионизации постоянна, но изменяется с изменением температуры. Понятие константы
- 45. Диссоциация кислот Кислоты — это электролиты, которые при диссоциации образуют только один вид катионов — катионы
- 46. Число ступеней диссоциации равно основности слабой кислоты. На первой ступени диссоциации сероводородной кислоты: H2S Н+ +
- 47. На второй ступени диссоциации от сложного гидросульфид-иона HS- отщепляется катион водорода Н+по уравнению: HS- Н+ +
- 48. Диссоциация кислот К΄΄д(HS-)=[Н+] ∙ [S2-] = 1,0 ∙10-14 [HS-] Сравнение величин К΄д и К˝д показывает, что
- 49. Диссоциация оснований Основания — это электролиты, которые при диссоциации образуют только один вид анионов — гидроксид-ионы
- 50. Слабые многокислотные основания диссоциируют ступенчато и характеризуются несколькими константами диссоциации. Число ступеней диссоциации равно кислотности слабого
- 51. На второй ступени диссоциации происходит отщепление гидроксид-иона от сложного катиона РbОН+ Рb(ОН)2 РbОН2++ОН- Диссоциация оснований
- 52. Амфотерные гидроксиды могут реагировать и с кислотами, и с основаниями, то есть имеют двойственные свойства. Двойственный
- 53. Амфотерные гидроксиды — это слабые электролиты, которые при диссоциации образуют одновременно катионы водорода Н+ и гидроксид-анионы
- 54. Диссоциация солей Нормальные соли — сильные электролиты, образующие при диссоциации катионы металла и анионы кислотного остатка.
- 55. Диссоциация солей Кислые соли — сильные электролиты, диссоциирующие на катион металла и сложный анион, в состав
- 56. Диссоциация солей В водных растворах кислых солей содержатся следующие ионы: катионы металла Меn+, катионы водорода Н+,
- 57. Диссоциация солей Основные соли — электролиты, которые при диссоциации образуют анионы кислотного остатка и сложные катионы,
- 58. Основные соли, как и кислые соли, сначала диссоциируют как сильные электролиты. Незначительно диссоциируют сложные ионы. В
- 59. Электролитическая диссоциация комплексных и двойных солей Электролитическая диссоциация комплексных солей в водных растворах происходит по двум
- 60. Диссоциация по первой ступени происходит по типу диссоциации сильных электролитов, а диссоциация комплексного иона — по
- 61. Двойные соли могут существовать только в твердом виде, так как в водном растворе они диссоциируют на
- 62. Протонная теория кислот и оснований В 1923 г. И. Бренстед и Т. Лоури разработали протонную теорию
- 63. Протонная теория кислот и оснований Определения кислот и оснований позволяют включать в их число не только
- 64. Протонная теория кислот и оснований Согласно протонной теории кислоты подразделяют на три типа: нейтральные кислоты, например
- 65. Протонная теория кислот и оснований анионные кислоты, представляющие собой отрицательные ионы, например HSO4-, Н2РО4-, Н2РО2- H2SO4-
- 66. Протонная теория кислот и оснований 2) анионные основания, представляющие собой отрицательные ионы, например: С1-, СН3СОО-, ОН-:
- 67. Протонная теория кислот и оснований Растворители типа воды, жидкого аммиака, а также анионы многоосновных кислот, которые
- 68. Протонная теория кислот и оснований В реакции Н2О + НС1 Н3О+ + Сl- молекула воды присоединяет
- 69. Протонная теория кислот и оснований Процесс диссоциации (ионизации) вещества происходит в контакте с растворителем. При этом
- 70. Протонная теория кислот и оснований Если сродство к протону у растворителя больше, чем у растворенного вещества,
- 71. Протонная теория кислот и оснований Согласно протонной теории, отдавая протон, кислота превращается в основание, которое называют
- 72. Кислотно - основное равновесие Протон в растворах не существует в свободном виде, кислота может отдать протон
- 73. Кислотно - основное равновесие Для краткости обратимый процесс кислотно-основного взаимодействия называют КО-равновесием. Реакции нейтрализации, ионизации, гидролиза
- 74. Кислотно - основное равновесие Реакция I типа СН3СООН + Н2О СН3СОО-+ Н3О+, протекающая в прямом направлении,
- 75. Кислотно - основное равновесие Реакция II типа NН4++ Н2О NH3 + H3O+, протекающая в прямом направлении,
- 76. Кислотно - основное равновесие Будучи амфолитом в других кислотно-основных равновесиях, она может выполнять и роль кислоты,
- 77. Кислотно - основное равновесие Протолитические кислотно-основные равновесия III типа могут иметь место не только в воде,
- 78. Кислотно - основное равновесие Теория Бренстеда, как и теория Аррениуса, не применима к веществам, проявлявшим функцию
- 79. Диссоциация воды. рН Вода как слабый электролит в незначительной степени диссоциирует на ионы Н+ и ОН-,
- 80. Диссоциация воды. рН Произведение концентраций ионов водорода и гидроксид-ионов в воде называется ионным произведением воды (обозначается
- 81. Диссоциация воды. рН Из постоянства произведения [Н+]и [ОН-] следует, что при увеличении концентрации одного из ионов
- 82. Диссоциация воды. рН Концентрацию водородных ионов принято выражать через водородный показатель и обозначать символом рН .
- 83. Диссоциация воды. рН С помощью рН реакция растворов характеризуется так: нейтральная рН =7, кислая рН 7.
- 84. Диссоциация воды. рН Существуют различные методы измерения рН. Качественно реакцию среды и рН водных растворов определяют
- 85. Реакции обмена в водных растворах электролитов Многие химические реакции протекают в водных растворах. Если в этих
- 86. Реакции обмена в водных растворах электролитов Реакции между водными растворами электролитов — это реакции, в которых
- 87. Реакции обмена в водных растворах электролитов Ионы одного электролита связываются с ионами другого электролита с образованием:
- 88. Ионные реакции и уравнения При составлении ионных уравнений реакций следует руководствоваться тем, что вещества малодиссоциированные, малорастворимые
- 89. Ионные реакции и уравнения Сильные растворимые электролиты, как полностью диссоциированные, пишутся в виде ионов. Например: AgNO3
- 90. Термины и определения Гидратация- взаимодействие веществ с водой, характеризующееся тем, что молекула воды присоединяется к исходной
- 91. Термины и определения Диссоциация электролитическая(ионизация)-распад электролитов растворах или расплавах на составляющие их ионы. Ионизация-процесс образования ионов
- 92. Термины и определения Сольватация - взаимодействие частиц (молекул и ионов). Электроды- твердые фазы, характеризующиеся электрической проводимостью
- 93. Литература 1. Л.М. Пустовалова, И.Е. Никанорова. Общая химия – Ростов-на-Дону: Феникс, 2005г. 2. Ершов, В. А.
- 95. Скачать презентацию













































![Диссоциация кислот К΄΄д(HS-)=[Н+] ∙ [S2-] = 1,0 ∙10-14 [HS-] Сравнение величин К΄д](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/265901/slide-47.jpg)
































![Диссоциация воды. рН Из постоянства произведения [Н+]и [ОН-] следует, что при увеличении](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/265901/slide-80.jpg)












 Дождь из облака
Дождь из облака Сахароза
Сахароза Презентация на тему Соли угольной кислоты
Презентация на тему Соли угольной кислоты  Теория электролитической диссоциации. Контрольный тест
Теория электролитической диссоциации. Контрольный тест Аммиак NH3
Аммиак NH3 Свойства кислорода. Оксиды
Свойства кислорода. Оксиды Презентация на тему Коррозия металлов
Презентация на тему Коррозия металлов  Приёмы работы с текстом на уроках химии
Приёмы работы с текстом на уроках химии Получение галогенов. Биологическое значение и применение галогенов и их соединений. (1)
Получение галогенов. Биологическое значение и применение галогенов и их соединений. (1) Пероксид водорода
Пероксид водорода Фторопласты и их использование
Фторопласты и их использование Натуральный каучук
Натуральный каучук Углеводороды: классификация
Углеводороды: классификация SHOT.шампуни. Состав. Компоненты
SHOT.шампуни. Состав. Компоненты Презентация на тему Актуальные проблемы газовой отрасли России
Презентация на тему Актуальные проблемы газовой отрасли России  Тренажер Химическая азбука для учащихся 8 класса
Тренажер Химическая азбука для учащихся 8 класса Практическая работа №5. Качественные реакции на анионы 1-3 групп
Практическая работа №5. Качественные реакции на анионы 1-3 групп Ртуть
Ртуть Опасные химические вещества
Опасные химические вещества Признаки химических реакций
Признаки химических реакций Классы неорганических соединений Подготовка к ЕГЭ
Классы неорганических соединений Подготовка к ЕГЭ Презентация на тему Вредное воздействие нитратов на организм человека
Презентация на тему Вредное воздействие нитратов на организм человека  Щелочные металлы
Щелочные металлы Предельные углеводороды. Алканы
Предельные углеводороды. Алканы Изомерия
Изомерия Современная ВЭЖХ. Круг анализируемых объектов. Сорбенты и подвижные фазы для ВЭЖХ. (Лекция 2)
Современная ВЭЖХ. Круг анализируемых объектов. Сорбенты и подвижные фазы для ВЭЖХ. (Лекция 2) Физика Доклад
Физика Доклад Празеодим
Празеодим