Содержание
- 2. Гальванический элемент Устройство, состоящее из двух электродов, дающее возможность получать электрический ток в результате химической реакции
- 3. Раствор заряжается положительно. Металл заряжается отрицательно. Ппластина металла притягивает из раствора положительно заряженные ионы металла и
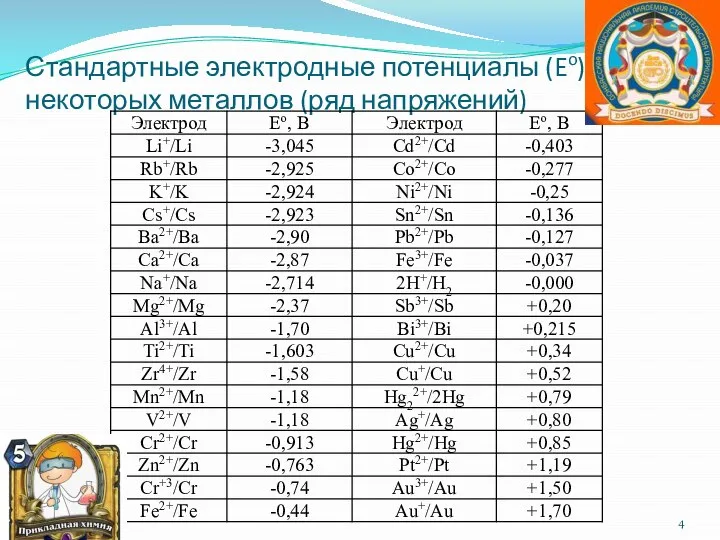
- 4. Стандартные электродные потенциалы (Eo), некоторых металлов (ряд напряжений)
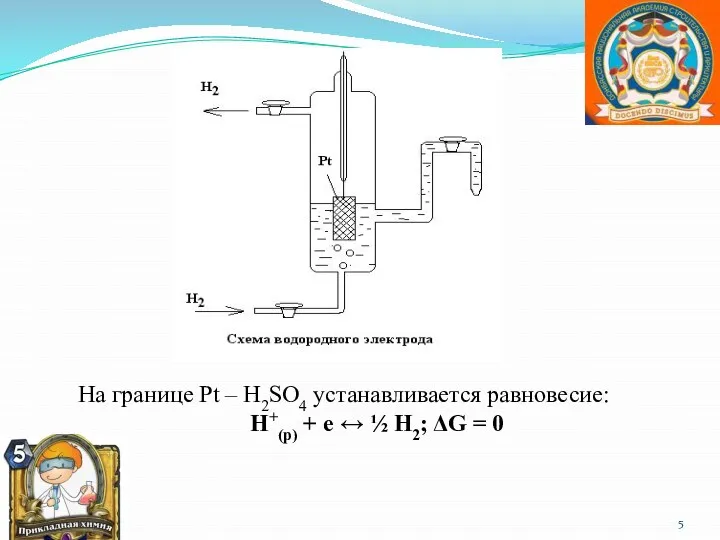
- 5. На границе Рt – Н2SО4 устанавливается равновесие: Н+(р) + е ↔ ½ Н2; ΔG = 0
- 6. Величина потенциала водородного электрода зависит от давления и рН среды. ЕН+/Н = -0,0295 lg рН2 –
- 7. Проводники первого рода — это, как правило, металлы, проводники второго рода — электролиты. Перенос заряда через
- 8. При протекании термодинамических процессов, участниками которых являются ионы, кроме механической работы совершается еще и электрическая работа,
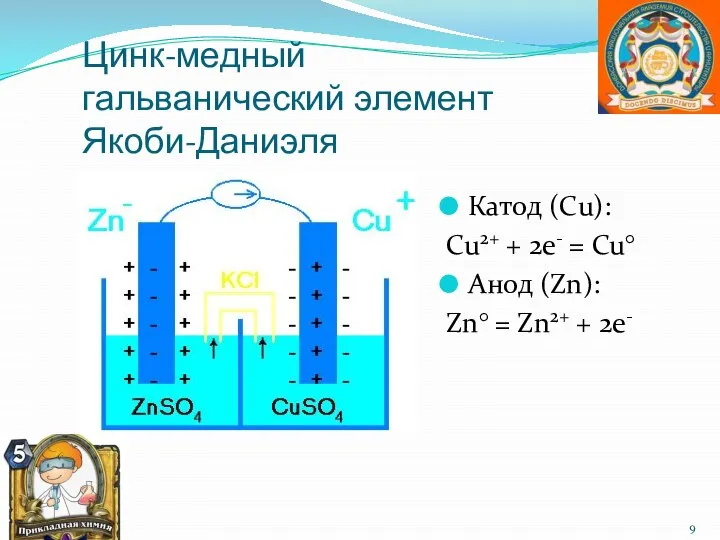
- 9. Цинк-медный гальванический элемент Якоби-Даниэля Катод (Сu): Cu2+ + 2e- = Cu° Анод (Zn): Zn° = Zn2+
- 10. Анод Катод Полунепроницаемая перегородка
- 11. Электродные потенциалы Величины стандартных электродных потенциалов Ео приведены в таблицах и характеризуют окислительные и восстановительные свойства
- 12. ЭДС зависит от: Положения металлов в ряду напряжений Соотношения ионов взятых растворов. При работе этого элемента
- 13. Уравнение Нернста
- 14. Электродный потенциал рассчитывается: Условия: Т≠250С, СМеn+≠1 моль/л: 2) Условия: Т=250С, СМеn+ ≠ 1 моль/л: 3) Условия:
- 15. Классификация электродов Электроды нулевого рода (окислительно-восстановительные электроды) Окислитель и восстановитель, как правило, находятся в растворе, а
- 16. Электроды первого рода 1. Металл, погруженный в раствор, содержащий ионы этого металла Mz+(р-р) M(т). 2.
- 17. Электроды второго рода Металл (A), погруженный в раствор, содержащий насыщенное соединение (малорастворимое или комплексное) иона этого
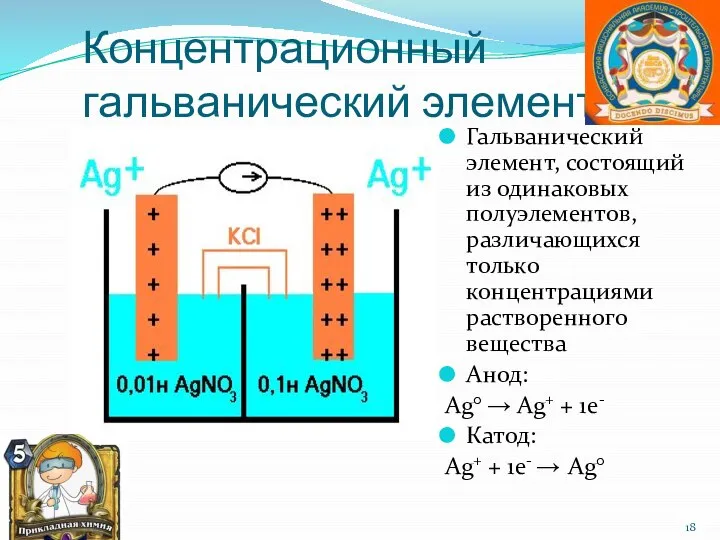
- 18. Концентрационный гальванический элемент Гальванический элемент, состоящий из одинаковых полуэлементов, различающихся только концентрациями растворенного вещества Анод: Ag°
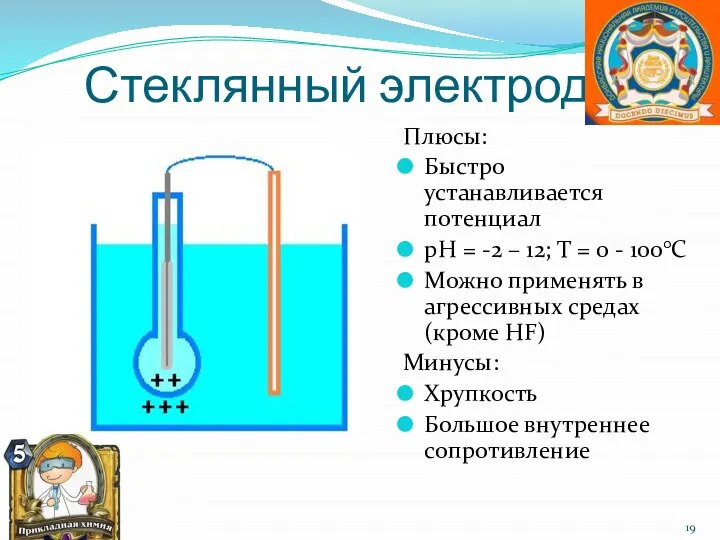
- 19. Стеклянный электрод Плюсы: Быстро устанавливается потенциал рН = -2 – 12; Т = 0 - 100°С
- 20. Топливные элементы Топливный элемент - окислитель и восстановитель хранятся вне элемента и в процессе работы подаются
- 21. Аккумуляторы Аккумуляторы - устройства, в которых электрическая энергия превращается в химическую, а химическая – снова в
- 24. Скачать презентацию















 Растворы. Процесс растворения (2)
Растворы. Процесс растворения (2) Знатоки химии. Химия первопричина всех причин
Знатоки химии. Химия первопричина всех причин Development of the system of concepts on the topic redox reactions in the school course of inorganic chemistry
Development of the system of concepts on the topic redox reactions in the school course of inorganic chemistry Калийные удобрения
Калийные удобрения Презентация на тему "Водород"
Презентация на тему "Водород" Классификация реагентов и реакций в органической химии. (Лекция 4)
Классификация реагентов и реакций в органической химии. (Лекция 4) Реакции обмена
Реакции обмена Щелочные металлы
Щелочные металлы Презентация Лекция 2. Химическая кинетика
Презентация Лекция 2. Химическая кинетика Аминокислоты. Классификация, номенклатура
Аминокислоты. Классификация, номенклатура Фуллерены
Фуллерены Количественный анализ. Методы количественного анализа
Количественный анализ. Методы количественного анализа Основы стереохимии
Основы стереохимии Определение плотности газообразного вещества по плотности
Определение плотности газообразного вещества по плотности Коррозия металлов
Коррозия металлов Вода и ее свойства
Вода и ее свойства Классификация, хранение, маркировка химических реактивов
Классификация, хранение, маркировка химических реактивов Ионные уравнения реакций
Ионные уравнения реакций Производство серной кислоты
Производство серной кислоты Многообразие органических веществ
Многообразие органических веществ Строение твердых и жидких металлов. Зональная ликвация
Строение твердых и жидких металлов. Зональная ликвация Пути использования активной уксусной кислоты
Пути использования активной уксусной кислоты Олигосахариды и полисахариды
Олигосахариды и полисахариды Химия в еде
Химия в еде Презентация на тему Альдегиды и их свойства
Презентация на тему Альдегиды и их свойства  Общие представления об электрохимических технологиях
Общие представления об электрохимических технологиях Калийные удобрения. Лекция 28
Калийные удобрения. Лекция 28 Синтез ланшенгенина дэ
Синтез ланшенгенина дэ