Содержание
- 2. Общая формула гомологического ряда предельных углеводородов CnH2n+2 Названия всех предельных углеводородов заканчиваются на –ан Радикалы называются
- 3. Следующий представитель С3Н8 – пропан. Структурная формула Н3С-СН2-СН3. У пропана возможно образование уже двух изомерных радикалов,
- 4. Далее все по такому же принципу. Четвертый представитель, еще плюс -СН2 – бутан С4Н10. Если у
- 5. Изобутан тоже может дать 2 радикала. При отнятии атома водорода от бокового атома углерода получаем изобутил
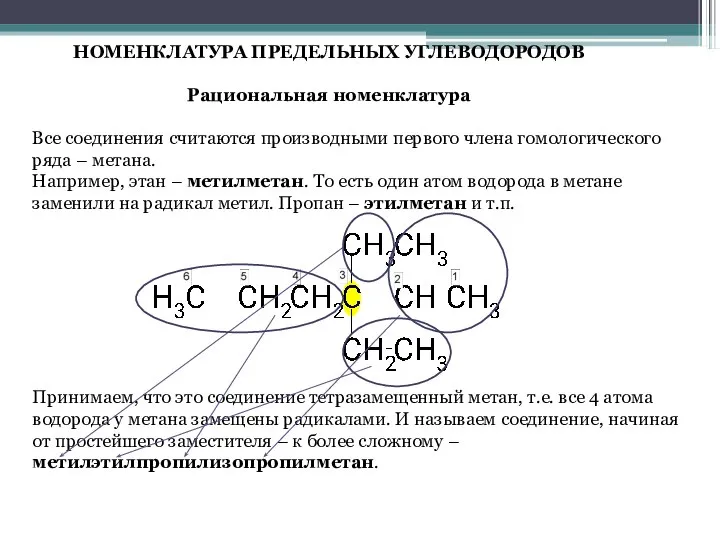
- 6. НОМЕНКЛАТУРА ПРЕДЕЛЬНЫХ УГЛЕВОДОРОДОВ Рациональная номенклатура Все соединения считаются производными первого члена гомологического ряда – метана. Например,
- 7. Систематическая номенклатура Выбирают наиболее длинную цепочку углеродных атомов, так называемую главную цепь. При этом у главной
- 8. МЕТОДЫ ПОЛУЧЕНИЯ ПРЕДЕЛЬНЫХ УГЛЕВОДОРОДОВ ЛАБОРАТОРНЫЕ Реакция Дюма CH3COONa (тв.) + NaOH(тв.) → CH4 + Na2CO3 2.
- 9. 5. Восстановление галогеналканов [H] R-Hal → R-H + H-Hal В качестве восстановителей применяются LiAlH4, NaBH4 Алкилиодиды
- 10. ПРОМЫШЛЕННЫЕ Метод Бергиуса Fe, 500°, 200 атм yC + xH2 −−−−−−−→ СnH2n+2 2. Метод Фишера-Тропша Fe+Ni,
- 11. Галогенирование hν СH4 + Cl2 → СH3-Cl + HCl хлорметан (метилхлорид) СH3Cl + Cl2 → СH2Cl2
- 12. 2. Реакция Коновалова СnH2n+2 + HNО3 → СnH2n+1-NO2 + H2O Условия реакции: 13%-ная азотная кислота, 100-120°С.
- 13. 4. Окисление (горение) СnH2n+2 + О2 → nCO2 + H2O + Q соли Mn, 180° C30H62-C40H82
- 15. Скачать презентацию






![5. Восстановление галогеналканов [H] R-Hal → R-H + H-Hal В качестве восстановителей](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1085144/slide-8.jpg)




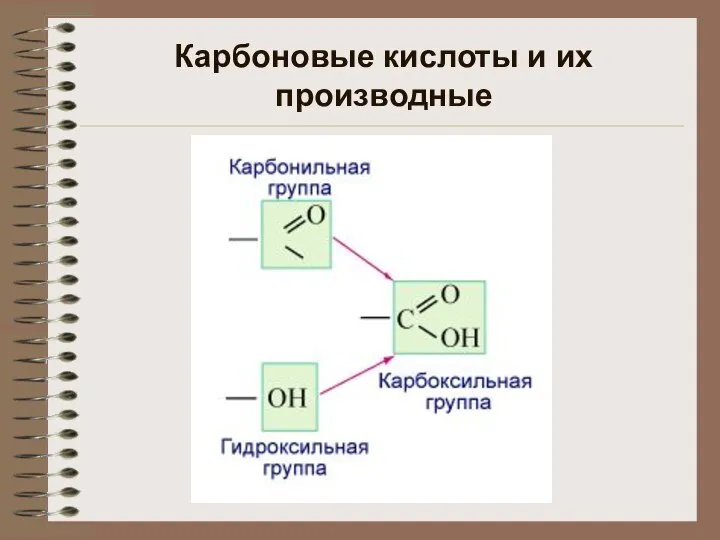 Карбоновые кислоты и их производные
Карбоновые кислоты и их производные Водород
Водород Буферные растворы
Буферные растворы Золото
Золото Презентация на тему Химические свойства и применение алканов
Презентация на тему Химические свойства и применение алканов  Изомерия
Изомерия Презентация на тему Использование информационных технологий на уроках химии
Презентация на тему Использование информационных технологий на уроках химии  Презентация на тему Великие учёные, внёсшие значительный вклад в развитие химии
Презентация на тему Великие учёные, внёсшие значительный вклад в развитие химии  Нахождение формулы вещества по массовым долям элементов
Нахождение формулы вещества по массовым долям элементов Дополнительный_материал_11.15_23.09.2022_e4f87550
Дополнительный_материал_11.15_23.09.2022_e4f87550 Основные диагностические признаки сапфира и его имитаций
Основные диагностические признаки сапфира и его имитаций 01_Osnovnye_ponyatia_i_zakony_khimii
01_Osnovnye_ponyatia_i_zakony_khimii Чистые вещества и смеси
Чистые вещества и смеси Степень окисления. Составление формул бинарных соединений. 8 класс
Степень окисления. Составление формул бинарных соединений. 8 класс Презентация на тему Классы неорганических веществ. Электролитическая диссоциация
Презентация на тему Классы неорганических веществ. Электролитическая диссоциация  Биосинтез пиримидиновых нуклеотидов
Биосинтез пиримидиновых нуклеотидов Кислоты
Кислоты Буферные системы
Буферные системы صيغ المركبات وأسمائها
صيغ المركبات وأسمائها Виды каталитических ядов и способы их устранения
Виды каталитических ядов и способы их устранения Цикл Кребса
Цикл Кребса Водород – топливо будущего
Водород – топливо будущего Разбор заданий на амины
Разбор заданий на амины Алкины. Понятие об алкинах
Алкины. Понятие об алкинах ОВР. Метод электронного баланса
ОВР. Метод электронного баланса Красители vs пигменты
Красители vs пигменты Соли
Соли Физико-химия дисперсных систем
Физико-химия дисперсных систем