Содержание
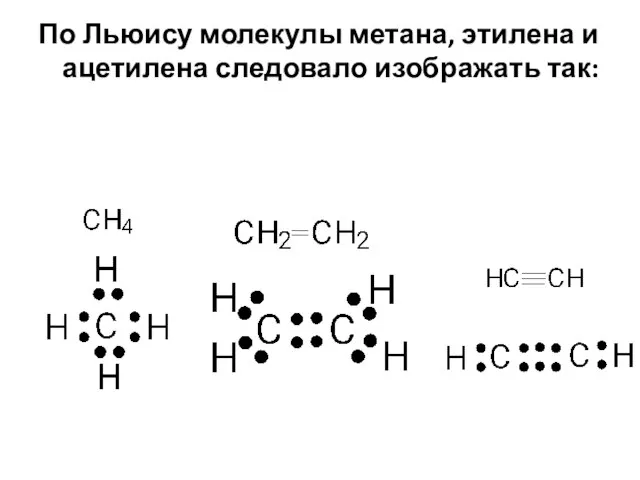
- 2. По Льюису молекулы метана, этилена и ацетилена следовало изображать так:
- 3. Ковалентная связь связь образуется не за счет электростатического притяжения разноименно заряженных ионов, а в следствие появления
- 4. Метод МО показывает Природа сил, обуславливающих химическую связь, носит электрический характер Движущей силой образования химической связи
- 5. Для образования МО из АО необходимы следующие условия Близкие энергии АО АО должны перекрываться максимальным образом
- 6. Классификация МО (типы химических связей) 1. По способу комбинирования АО различают связи: - связывающие МО -
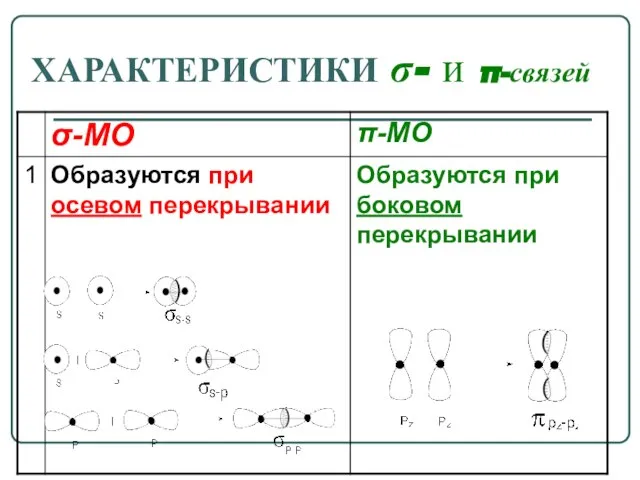
- 7. ХАРАКТЕРИСТИКИ σ- и π-связей
- 11. СПОСОБЫ ОБРАЗОВАНИЯ И ТИПЫ КОВАЛЕНТНОЙ СВЯЗИ Ковалентная связь (КС) – связь которая образуется за счет обобществления
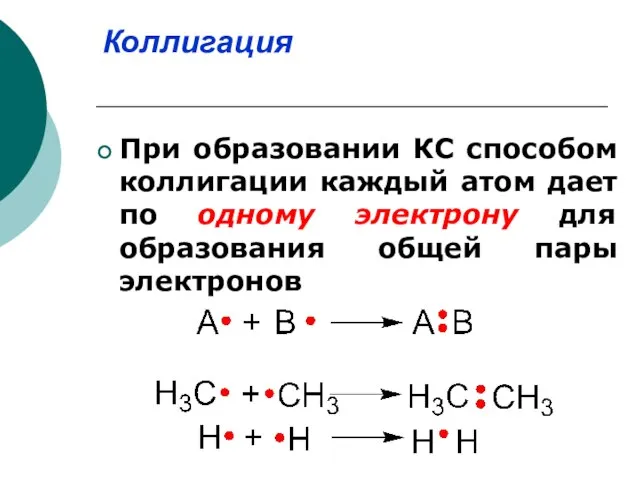
- 12. . Коллигация При образовании КС способом коллигации каждый атом дает по одному электрону для образования общей
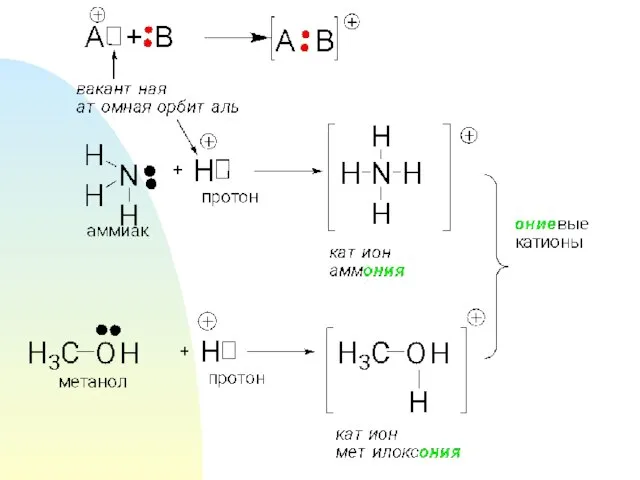
- 13. .Координация При образовании КС методом координации возможны 2 варианта А) Происходит передача электронной пары для катиона
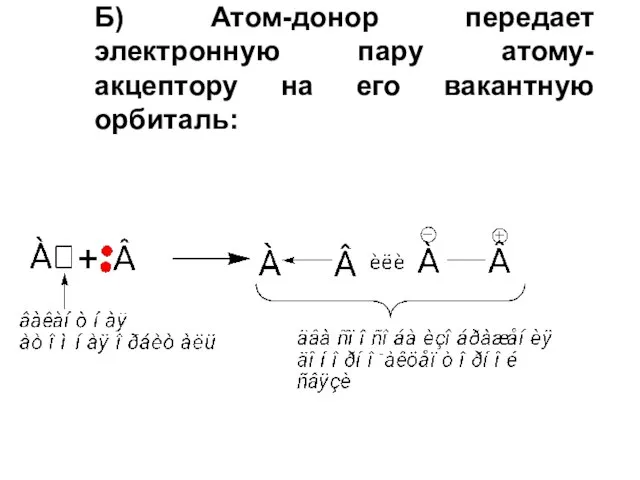
- 15. Б) Атом-донор передает электронную пару атому-акцептору на его вакантную орбиталь:
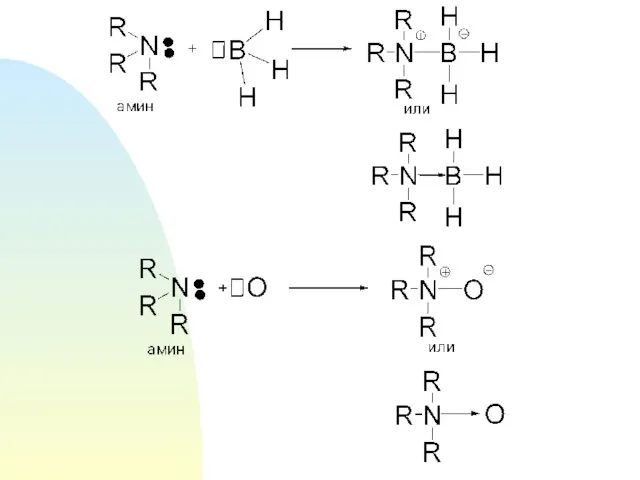
- 17. Донорно-акцепторную связь называют биполярной или семиполярной, т.к. она образуется из двух нейтральных частиц
- 18. ХАРАРАКТЕРИСТИКИ КОВАЛЕНТНОЙ СВЯЗИ
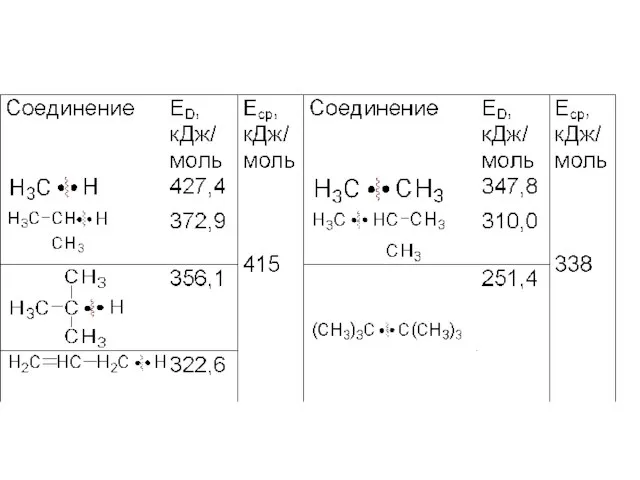
- 19. ЭНЕРГИЯ ДИССОЦИАЦИИ СВЯЗИ ЕD Это энергия, необходимая для разрыва связи с образованием атомов или радикалов Она
- 20. Прочность связи может быть рассчитана по методу МО, как сумма (Σ) энергий двух электронов на связывающей
- 21. Средняя энергия связи Средняя энергия связи (Еср) в молекулах с одинаковыми связями А-В определяется как частное
- 22. Для метана (СН4) ΔНа = 1660 кДж/моль ЕсрС-Н = 1660 / 4 =415 Дж/моль Еср –
- 24. ТЕПЛОТА ОБРАЗОВАНИЯ СВЯЗИ ИЗ АТОМОВ ΔНа Это энергия, выделяющаяся при образовании всех связей в молекуле. ΔНа
- 25. ДЛИНА СВЯЗИ и ПОРЯДОК СВЯЗИ Длина связи – равновесное расстояние между центрами ядер атомов, образующих связь
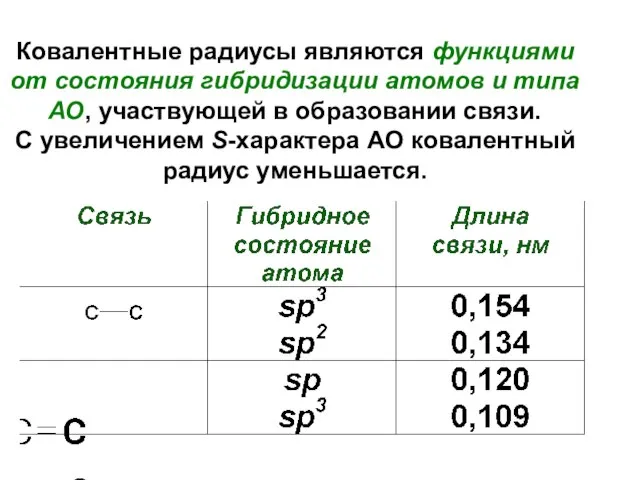
- 26. В общем случае длина любой ковалентной связи равна сумме (= Σ) ковалентных радиусов, составляющих её атомов.
- 27. Ковалентные радиусы являются функциями от состояния гибридизации атомов и типа АО, участвующей в образовании связи. С
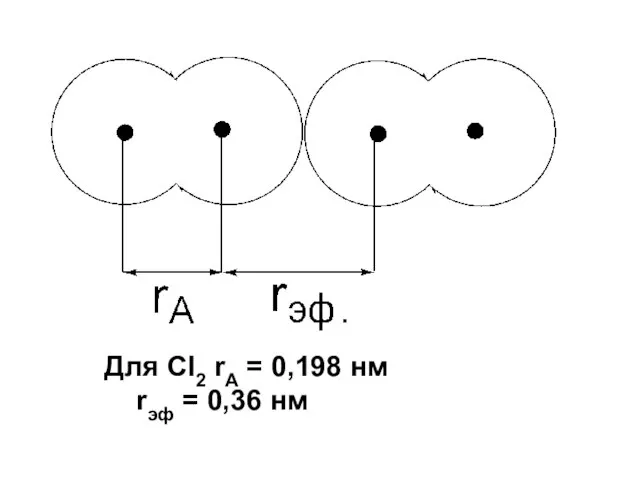
- 28. Радиус эффективного действия (эффективный радиус или радиус Ван-Дер-Ваальса – это наименьшее расстояние , на которое могут
- 29. Для Cl2 rA = 0,198 нм rэф = 0,36 нм
- 30. Метод МО позволяет оценить кратность связи с помощью такой характеристики как порядок связи, который равен сумме
- 31. Полярность связи – характеристика связи, описывающая распределение электронной плотности относительно середины расстояния между ядрами связанных атомов.
- 32. Если связь образована разными атомами (атомами с разной электроотрицательностью (ЭО)– распределение электронной плотности становится асимметричным относительно
- 33. Шкала электроотрицательности Полинга Учебник Щербина А.Э. и др. стр 38
- 34. Мерой полярности связи является разность ЭО (РЭО): РЭО>2 – ионная связь РЭО Изображают ковалетную полярную ковалентную
- 35. Атом с большей ЭО получает знак δ-, а атом с меньшей ЭО получает знак δ+, что
- 36. Другой способ – вместо линии, обозначающей КС, изображают стрелку, направленную от менее элктроотрицательного атома к более
- 37. Характеристикой полярности связи является дипольный момент μ (мю) μ -дипольный момент q –заряд r – расстояние
- 38. Для характеристики степени асимметричности электронного облака используется степень ионности связи i (%) предполагает полное разделение заряда
- 39. ПОЛЯРИЗУЕМОСТЬ СВЯЗИ Поляризуемость связи – способность связи изменять свою полярность под воздействием внешнего электрического или магнитного
- 40. Поляризуемость характеризует подвижность электронного облака, что более важно, чем исходное распределение электронной плотности в статическом состоянии
- 41. Следует отметить, что - поляризуемость растет 1) с увеличением длины связи (увеличением радиусов связанных атомов); 2)
- 42. Мерой поляризуемости является молекулярная рефракция Rm где NA – число Авогадро, α - поляризуемость
- 43. Rm является аддитивной величиной и её можно рассчитать как сумму рефракций всех связей, атомов и групп.
- 44. ЛОКАЛИЗОВАННЫЕ СВЯЗИ (σ- и π-связи). ГИБРИДИЗАЦИЯ ЛОКАЛИЗОВАННАЯ СВЯЗЬ означает, что валентная пара электронов находится в поле
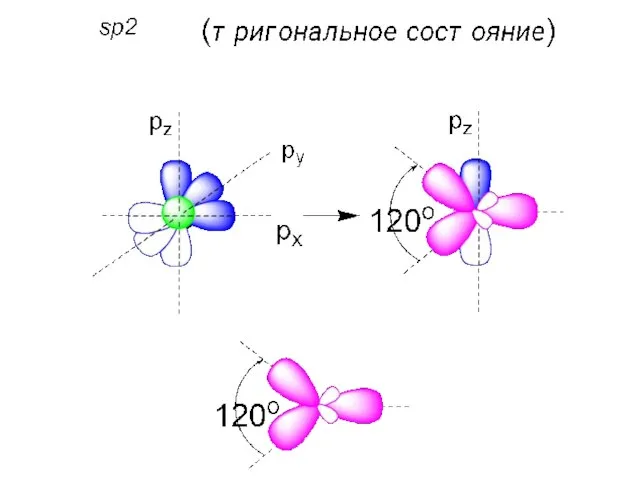
- 45. Допускается, что атом углерода при образовании химических связей переходит в возбуждённое состояние: Затраты энергии компенсируются образованием
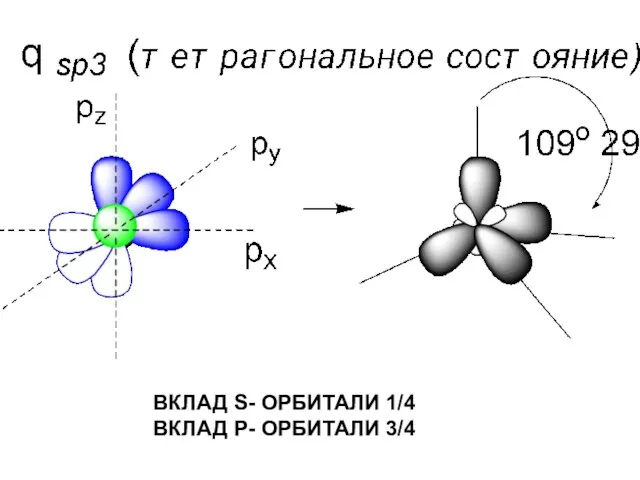
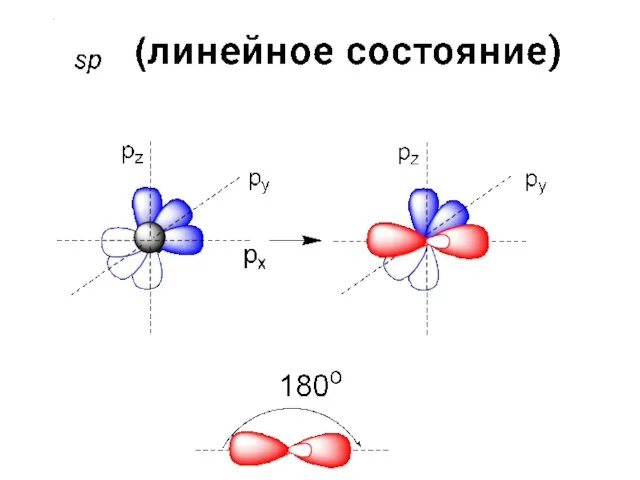
- 46. КАКИЕ ОРБИТАЛИ (S ИЛИ P) ПРИНИМАЮТ УЧАСТИЕ В ОБРАЗОВАНИИ СВЯЗЕЙ АТОМА УГЛЕРОДА? РАВНОЦЕННЫ ЛИ ВСЕ ЧЕТЫРЕ
- 47. ВКЛАД S- ОРБИТАЛИ 1/4 ВКЛАД P- ОРБИТАЛИ 3/4
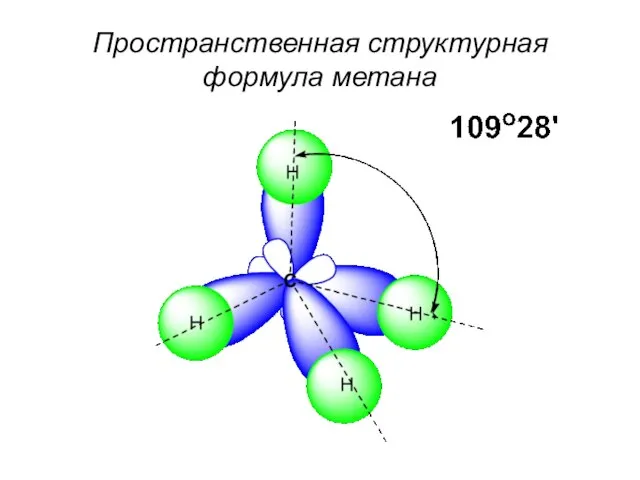
- 50. Пространственная структурная формула метана
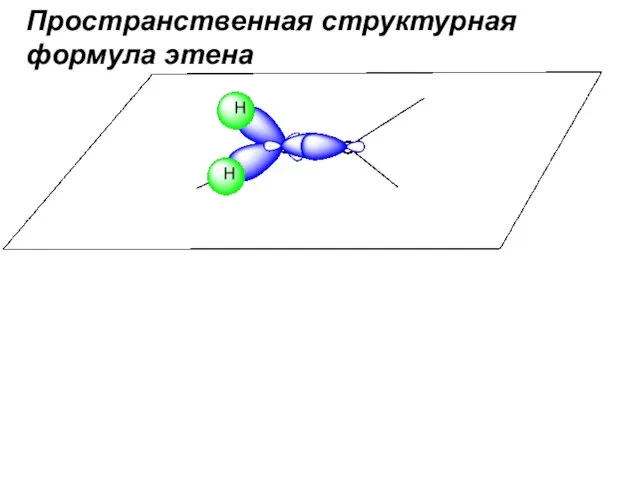
- 51. Пространственная структурная формула этена
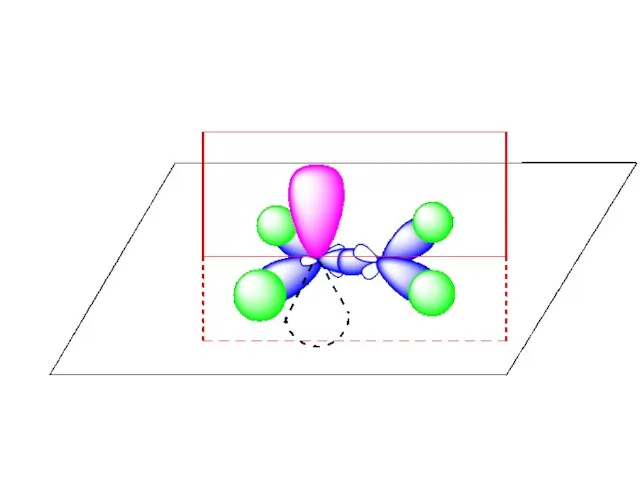
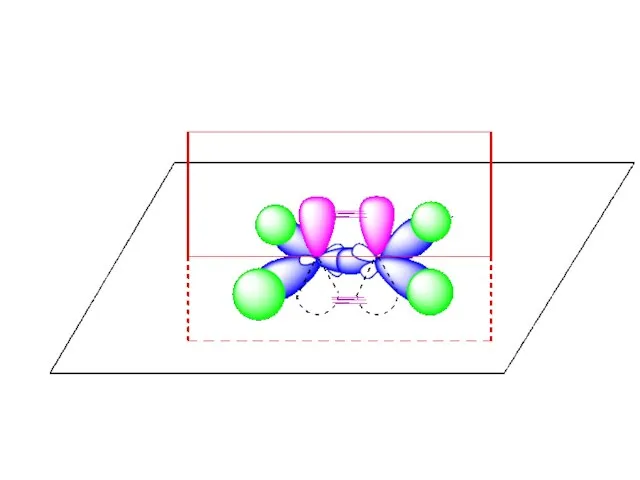
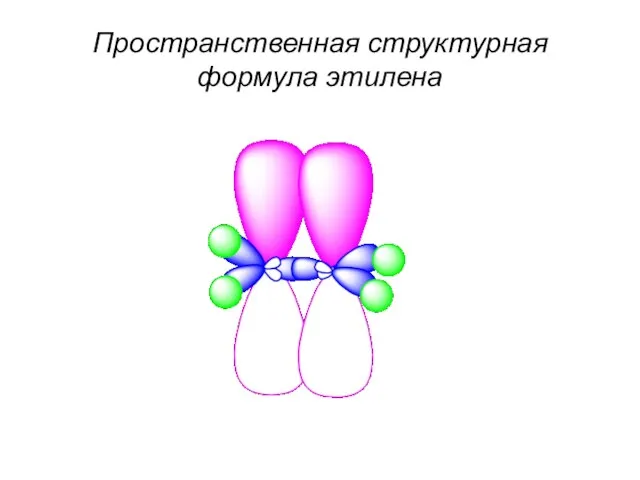
- 54. Пространственная структурная формула этилена
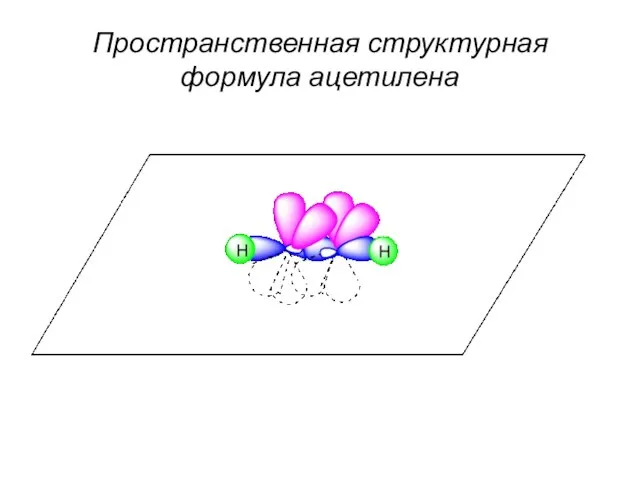
- 55. Пространственная структурная формула ацетилена
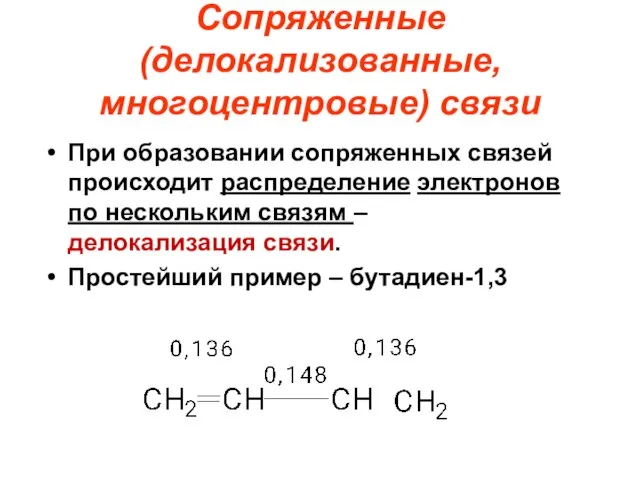
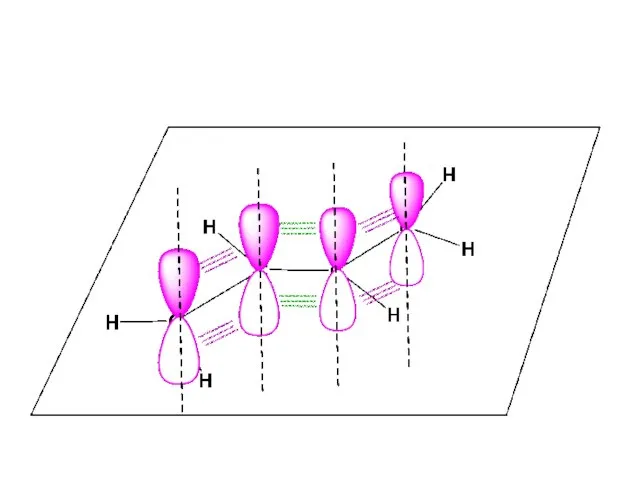
- 56. Сопряженные (делокализованные, многоцентровые) связи При образовании сопряженных связей происходит распределение электронов по нескольким связям – делокализация
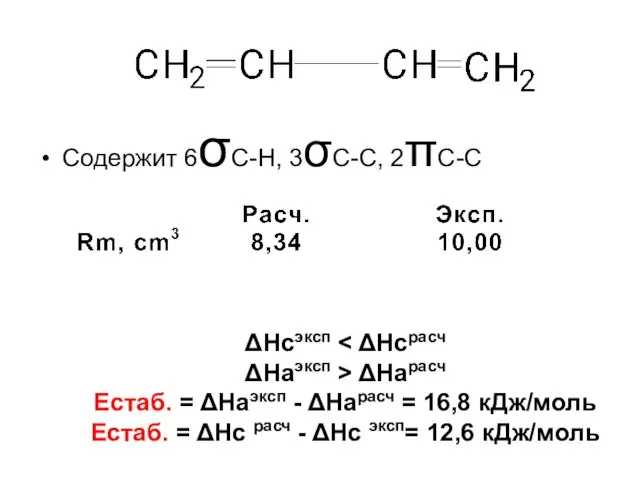
- 57. Содержит 6σС-Н, 3σС-С, 2πС-С ΔНсэксп ΔНаэксп > ΔНарасч Естаб. = ΔНаэксп - ΔНарасч = 16,8 кДж/моль
- 58. Энергия стабилизации (Естаб.)– это понижение энергии за счет образования делокализованных (сопряженных) связей по сравнению с локализованными
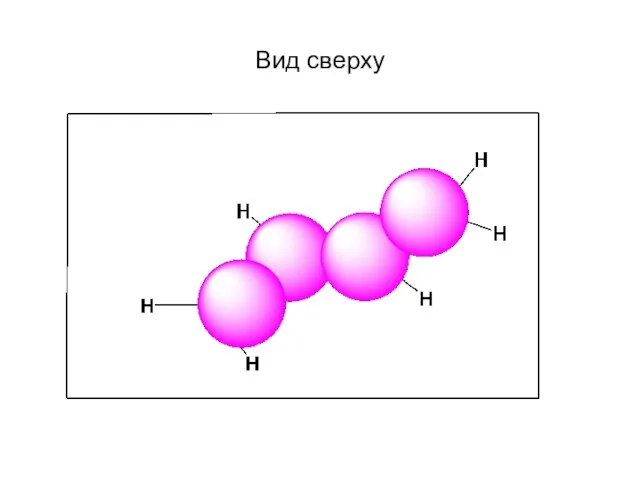
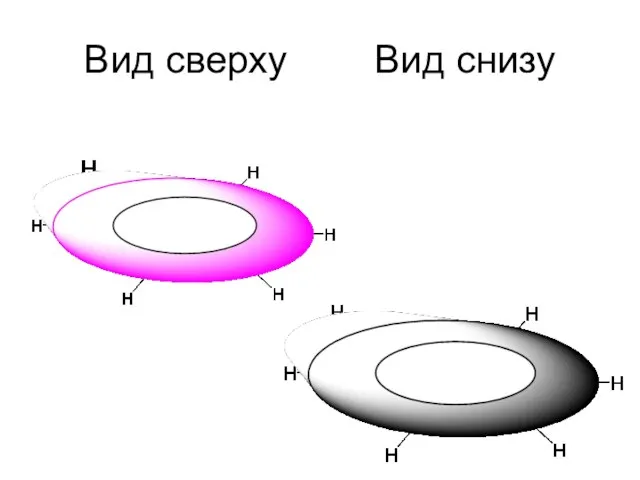
- 60. Вид сверху
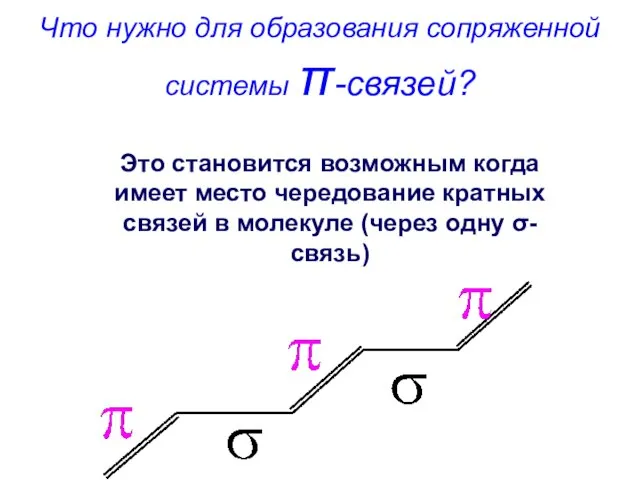
- 61. Что нужно для образования сопряженной системы π-связей? Это становится возможным когда имеет место чередование кратных связей
- 62. Необходимо, чтобы оси атомных орбиталей, линейная комбинация которых используется для образования многоцентровой МО, были параллельны, что
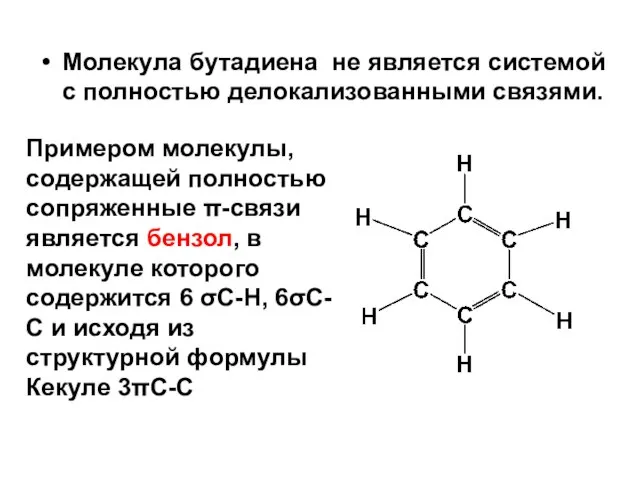
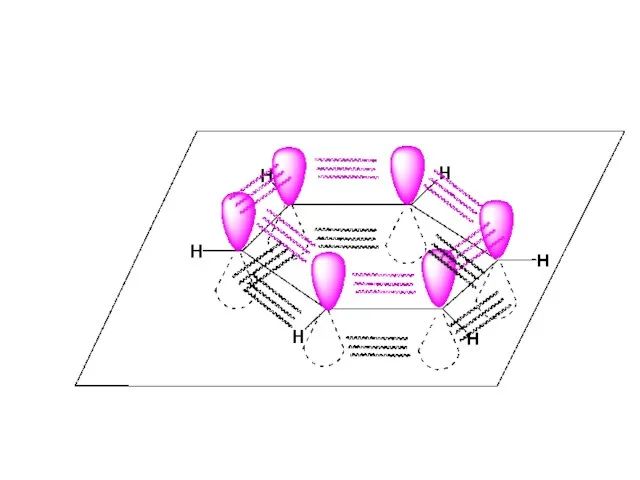
- 63. Молекула бутадиена не является системой с полностью делокализованными связями. Примером молекулы, содержащей полностью сопряженные π-связи является
- 65. Вид сверху Вид снизу
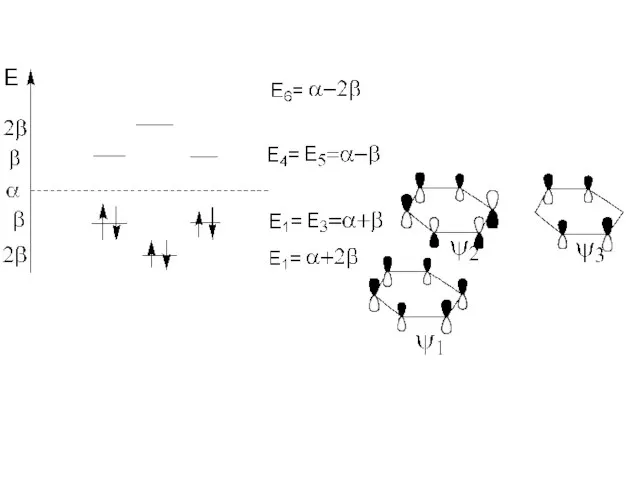
- 66. Молекула бензола совершенно симметрична Естаб. =150,1 кДж/моль Для описания систем с делокализованными (сопряженными) системами связей используют
- 68. Типы сопряженных систем а) π-π б) n-π (p-π) в) сверхсопряжение (гиперконьюгация) См. учебник Щербина и др.
- 69. а) В молекулах бутадиена и бензола имеет место образование сопряженной системы π-π-типа, которая образуется при чередовании
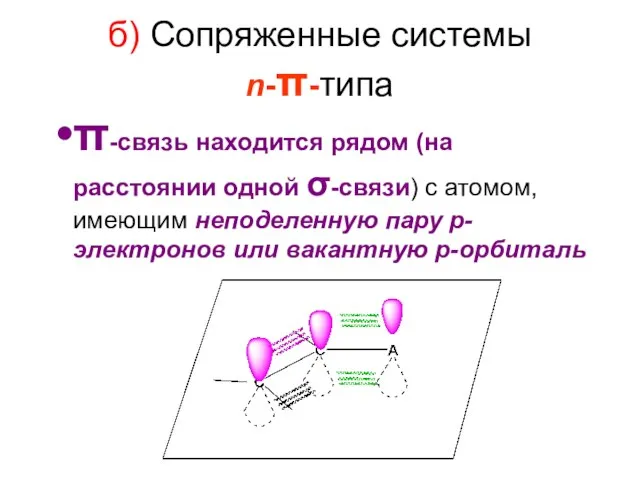
- 70. б) Сопряженные системы n-π-типа π-связь находится рядом (на расстоянии одной σ-связи) с атомом, имеющим неподеленную пару
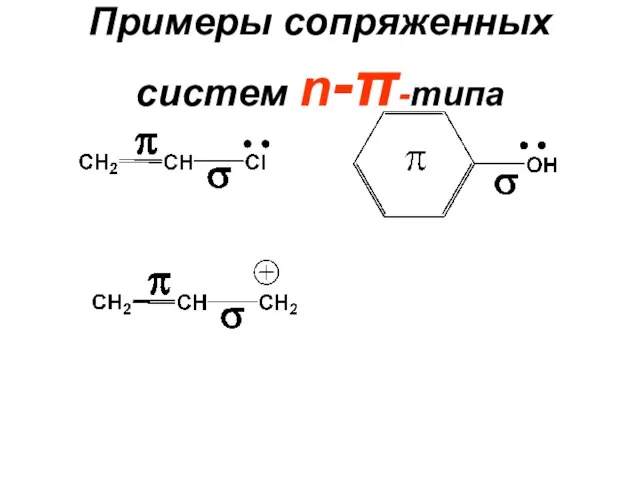
- 71. Примеры сопряженных систем n-π-типа
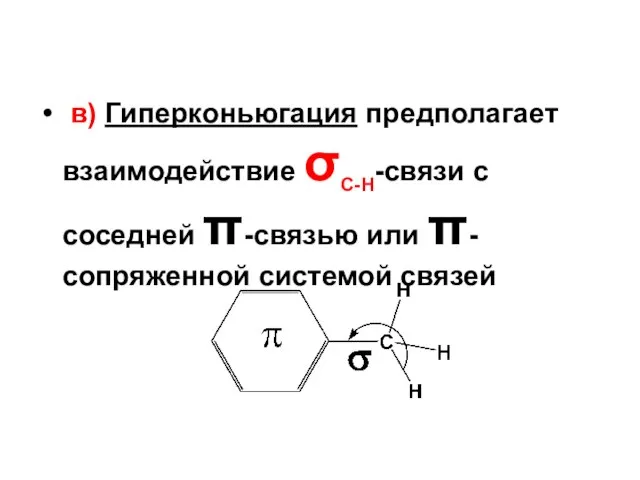
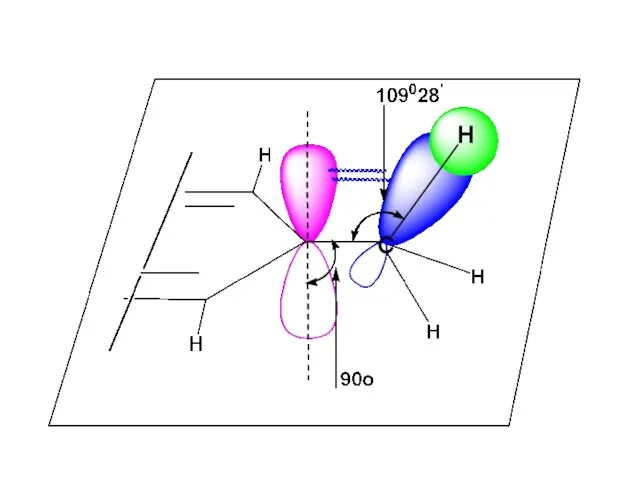
- 72. в) Гиперконьюгация предполагает взаимодействие σС-Н-связи с соседней π-связью или π-сопряженной системой связей
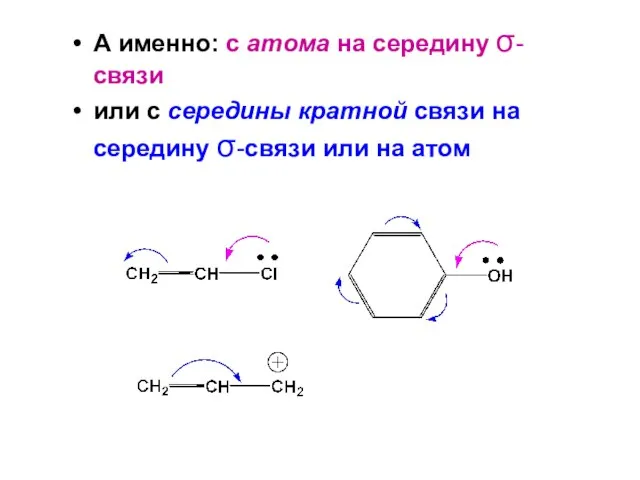
- 74. Способы изображения сопряженных систем Присуствие сопряженной ситемы в молекуле может быть показано 1) с использование изогнутых
- 75. А именно: с атома на середину σ-связи или с середины кратной связи на середину σ-связи или
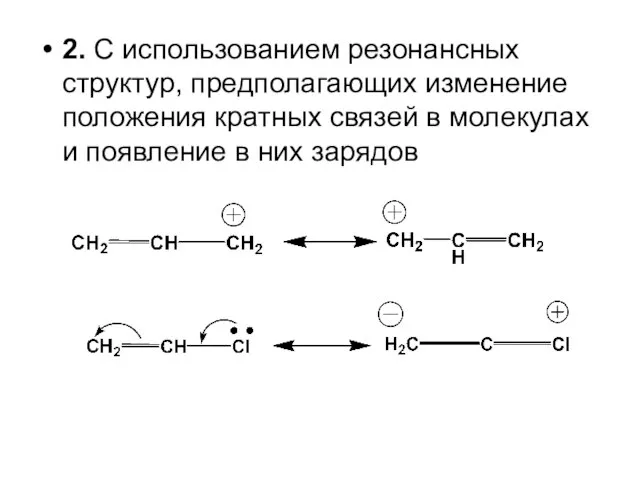
- 76. 2. С использованием резонансных структур, предполагающих изменение положения кратных связей в молекулах и появление в них
- 77. ЭЛЕКТРОНННЫЕ ЭФФЕКТЫ В МОЛЕКУЛАХ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ Вследствие полярности и поляризуемости ковалентных связей в молекулах органических соединений
- 78. Индукционный эффект (I-эффект) Индукционный (индуктивный) эффект - это смещение электронной плотности σ-связей в молекуле под влиянием
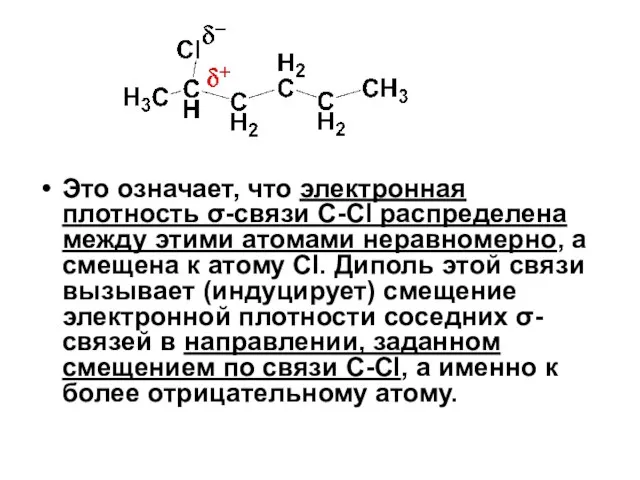
- 79. Чтобы определить наличие, направление и знак индуктивного электронного эффекта рассмотрим, например, распределение электронной плотности σ-связей в
- 80. Это означает, что электронная плотность σ-связи С-Cl распределена между этими атомами неравномерно, а смещена к атому
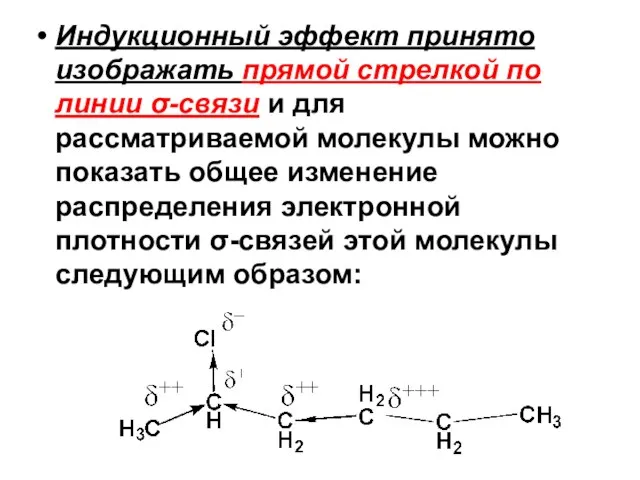
- 81. Индукционный эффект принято изображать прямой стрелкой по линии σ-связи и для рассматриваемой молекулы можно показать общее
- 82. I-эффект распространяется на соседние σ-связи с затуханием, что отражено с помощью символов δ+, δ++ и δ+++.
- 83. Иными словами наиболее сильно смещается электронная плотность ближайших к полярной связи σ-связей. Считается, что далее третьей
- 84. I-эффект считается универсальным, т.к. он имеет место в молекулах практически всех классов органических соединений, поскольку более
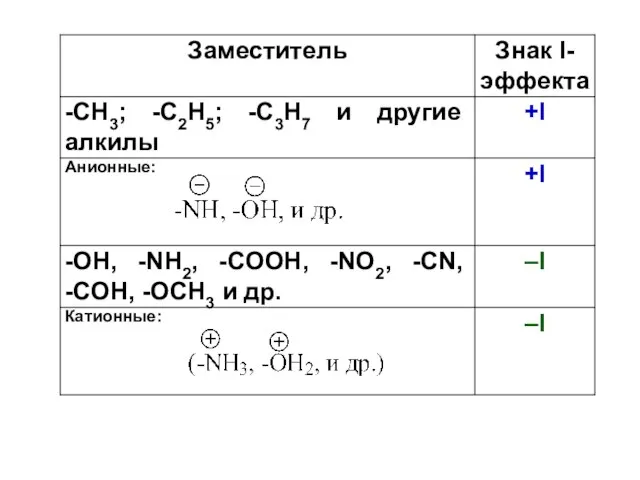
- 85. I-эффект имеет знак и бывает +I и –I эффектом соответственно. Для определения знака индуктивного эффекта, атом
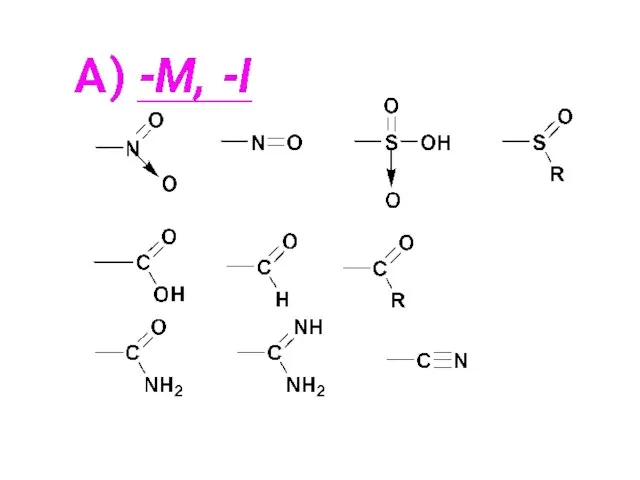
- 86. -I эффект Атомы или группы атомов (заместители), притягивающие к себе электронную плотность σ-связи сильнее, чем атом
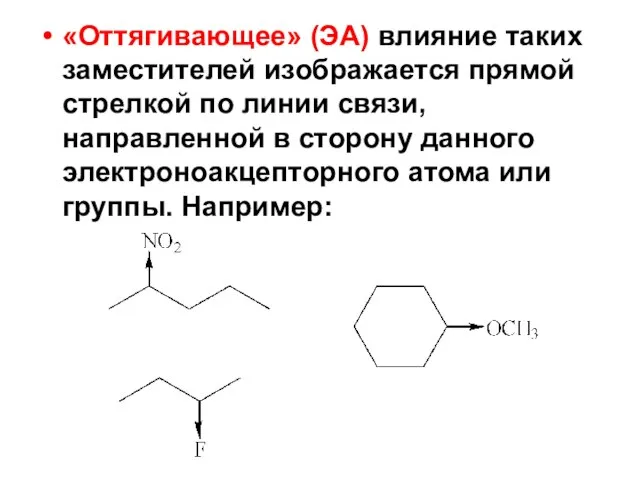
- 87. «Оттягивающее» (ЭА) влияние таких заместителей изображается прямой стрелкой по линии связи, направленной в сторону данного электроноакцепторного
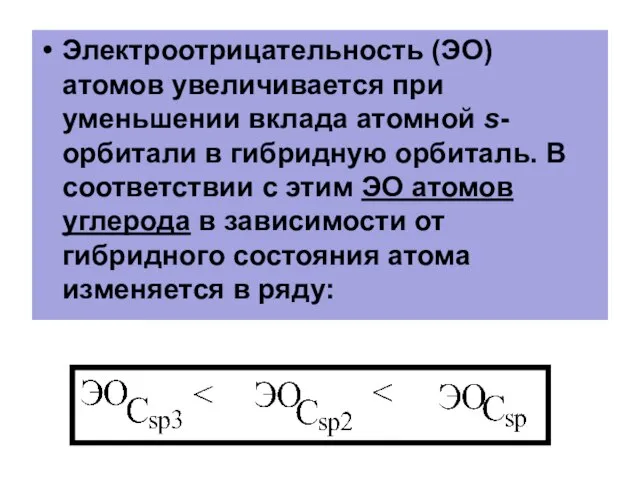
- 88. Электроотрицательность (ЭО) атомов увеличивается при уменьшении вклада атомной s-орбитали в гибридную орбиталь. В соответствии с этим
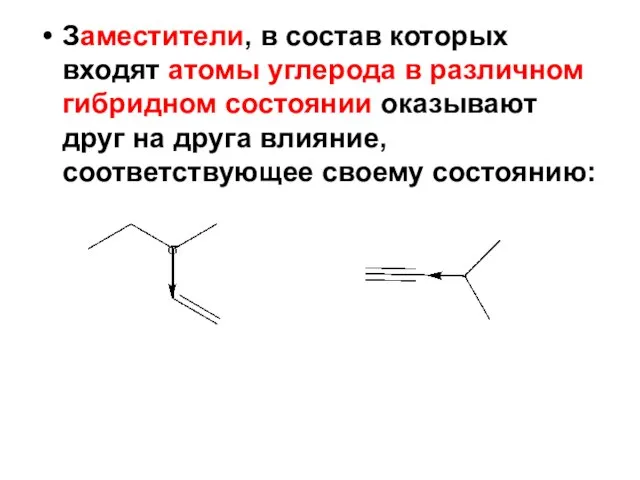
- 89. Заместители, в состав которых входят атомы углерода в различном гибридном состоянии оказывают друг на друга влияние,
- 90. +I –эффект Если заместитель (по сравнению с водоро-дом) отталкивает от себя электронную плотность связи (увеличивает электронную
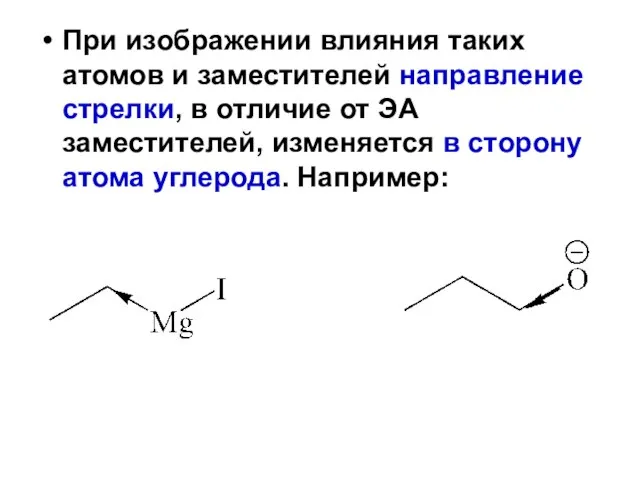
- 91. При изображении влияния таких атомов и заместителей направление стрелки, в отличие от ЭА заместителей, изменяется в
- 93. Мезомерный эффект (М-эффект, эффект сопряжения, эффект коньюгации) Мезомерный эффект это неравномерное распределение (смещение) электронной плотности в
- 94. М-эффект касается не σ-связей атомов в молекуле, а имеет место только в молекулах органических соединений, в
- 95. В отличие от I-эффекта, когда происходит лишь изменение полярности σ-связи, M-эффект не является универсальным, а затрагивает
- 96. M-эффект также имеет знак «+» или «-». Он обозначает, что атом или заместитель являются электронодонорными (ЭД)(+М-эффект)
- 97. Чтобы определить имеется ли в молекуле мезомерный эффект и каков его знак, необходимо: 1) Определить наличие
- 98. +М-эффект М-эффект имеет знак «+» в том случае, если несимметричная сопряженная система относится к типу n(р),π,
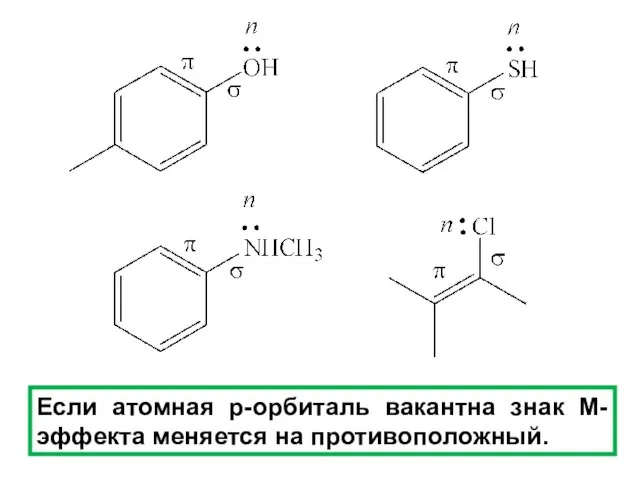
- 99. Если атомная p-орбиталь вакантна знак М-эффекта меняется на противоположный.
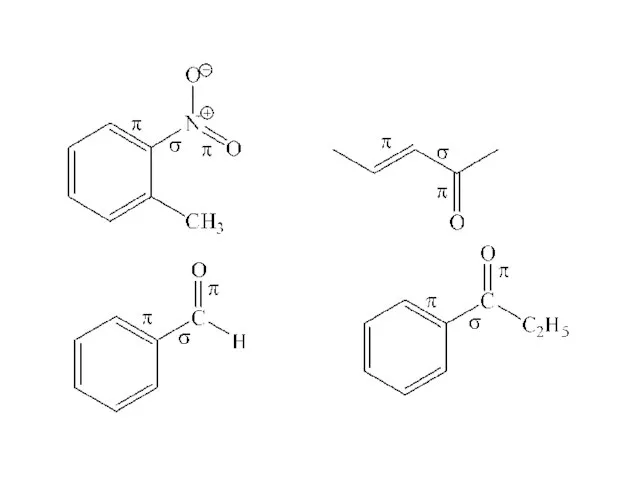
- 100. – М-эффект М-эффект имеет знак «-», если несимметричная сопряженная система относится к π,π типу, Заместитель в
- 102. Одним из способов изображения смещения электронной плотности сопряженных систем в соответствии с М-эффектом являются изогнутые стрелки,
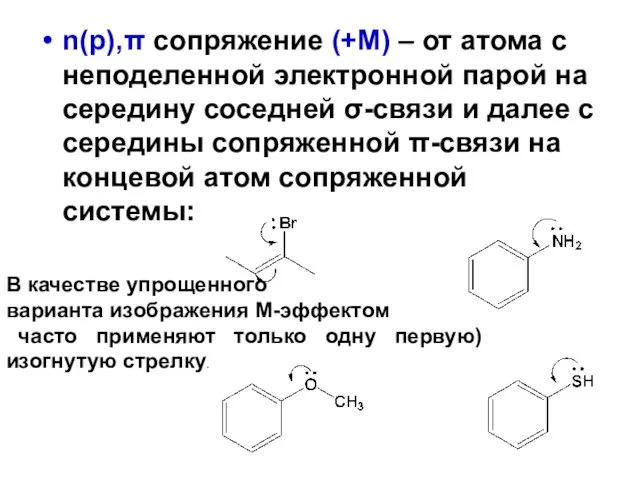
- 103. n(p),π сопряжение (+М) – от атома с неподеленной электронной парой на середину соседней σ-связи и далее
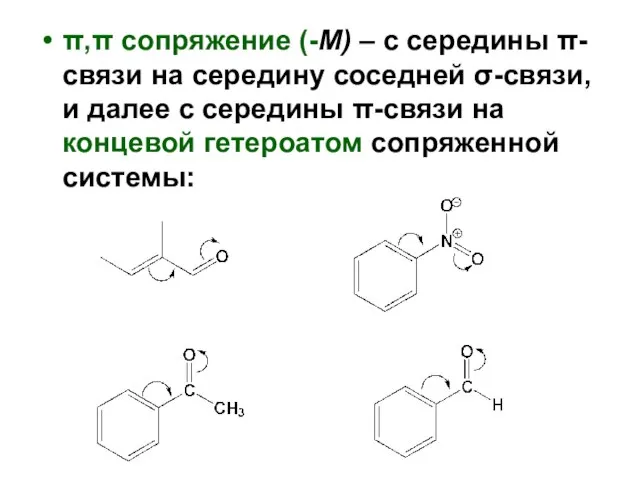
- 104. π,π сопряжение (-М) – с середины π-связи на середину соседней σ-связи, и далее с середины π-связи
- 105. Например, требуется определить в каком случае правильно указан +M электронный эффект соответствующих функциональных групп:
- 106. Если объединить функциональные группы и другие заместители по совокупности I и M эффекта, то можно выделить
- 109. Скачать презентацию



























































 Формы существования химических элементов. Формы существования химических элементов
Формы существования химических элементов. Формы существования химических элементов Валентность. Составление формул по валентности
Валентность. Составление формул по валентности Калифорний Cf
Калифорний Cf Итоговая консультация. Формульный диктант
Итоговая консультация. Формульный диктант Биологические буферные системы
Биологические буферные системы Причины многообразия веществ. 11 класс
Причины многообразия веществ. 11 класс Ионные уравнения реакций
Ионные уравнения реакций Сложные реакции
Сложные реакции Melatonin. Краткий экскурс
Melatonin. Краткий экскурс Сера. Немного истории
Сера. Немного истории Алкины (Ацетиленовые углеводороды)
Алкины (Ацетиленовые углеводороды) Нефть
Нефть Виды химических связей
Виды химических связей Кислоты. Оксиды
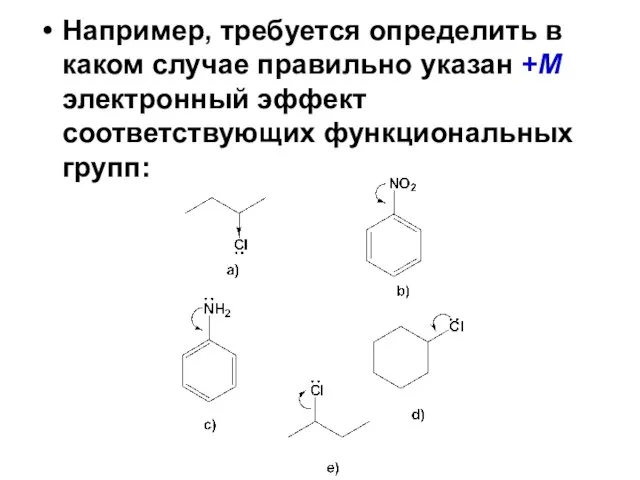
Кислоты. Оксиды Растворы. 11 класс
Растворы. 11 класс Повторение классов соединений. Составление формул по названиям
Повторение классов соединений. Составление формул по названиям Основной государственный экзамен. Химия 2021. Задание 17
Основной государственный экзамен. Химия 2021. Задание 17 Составление химических формул методом нулевой суммы
Составление химических формул методом нулевой суммы Заманауи косметика биотехнологиясы
Заманауи косметика биотехнологиясы Алкены
Алкены Галогены – химические элементы
Галогены – химические элементы Уравнения диссоциации
Уравнения диссоциации Осаждение нитрида кремния
Осаждение нитрида кремния Химический состав клетки
Химический состав клетки Химически опасные объекты Аварии, связанные с выбросом АХОВ
Химически опасные объекты Аварии, связанные с выбросом АХОВ Иттрий-алюминиевый гранат и иттрий-алюминиевый перовскит
Иттрий-алюминиевый гранат и иттрий-алюминиевый перовскит Нуклеиновые кислоты
Нуклеиновые кислоты Железо – элемент побочной подгруппы YIII группы ПСХЭ Д.И.Менделеева. (по материалам ЕГЭ)
Железо – элемент побочной подгруппы YIII группы ПСХЭ Д.И.Менделеева. (по материалам ЕГЭ)