Содержание
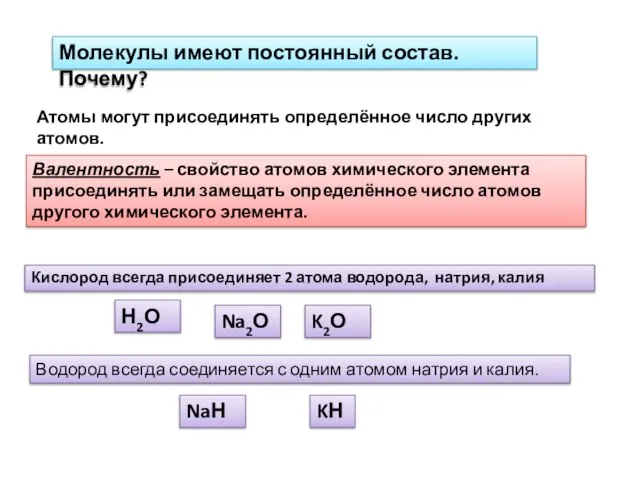
- 2. Молекулы имеют постоянный состав. Почему? Атомы могут присоединять определённое число других атомов. Валентность – свойство атомов
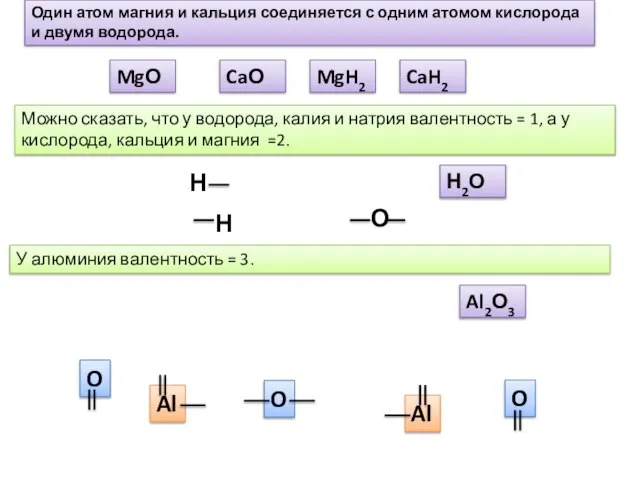
- 3. Н О Н Можно сказать, что у водорода, калия и натрия валентность = 1, а у
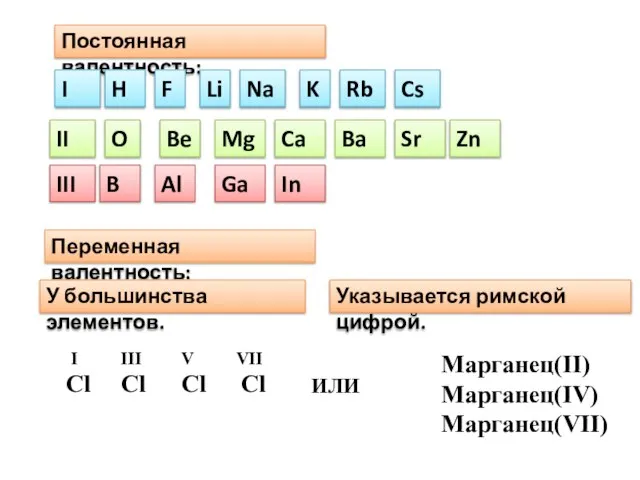
- 4. Постоянная валентность: I II III H Na K Li F O Be Mg Ca Ba Sr
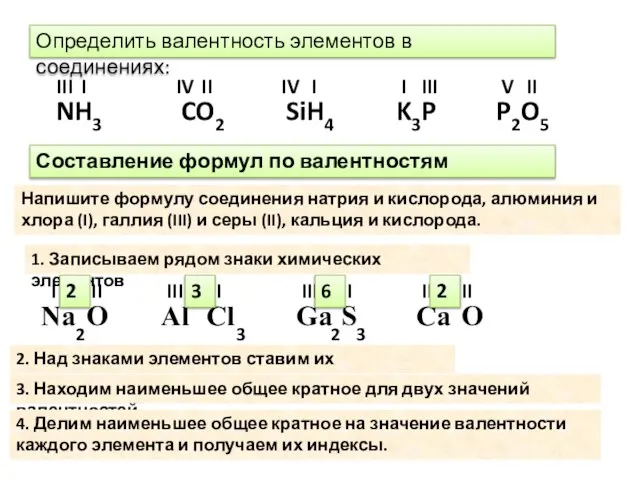
- 5. Определение валентности по формуле. В бинарных соединениях (состоящих из двух атомов), зная валентность одного элемента, легко
- 6. 2 Определить валентность элементов в соединениях: P2O5 NH3 CO2 SiH4 K3P I III II IV I
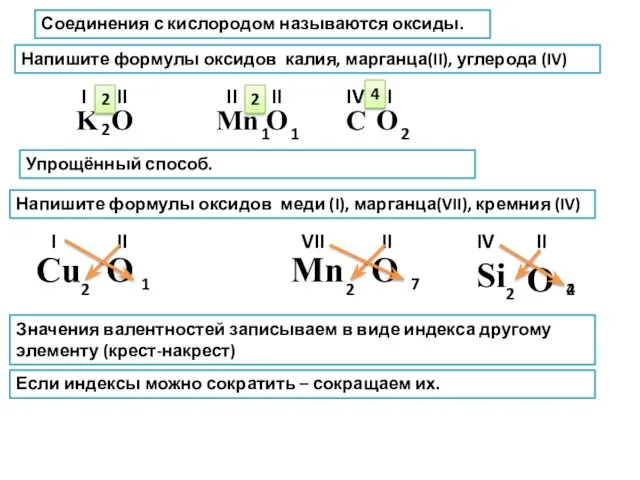
- 7. Соединения с кислородом называются оксиды. Напишите формулы оксидов калия, марганца(II), углерода (IV) K O Mn C
- 8. Составьте формулы соединения указанных пар элементов, согласно их валентностям. Стронций(II) и Йод(I) Sr I2 Железо (III)
- 10. Скачать презентацию


 Топливо и расчеты его горения
Топливо и расчеты его горения Решение расчетных задач по уравнениям реакций
Решение расчетных задач по уравнениям реакций Химические украшения из металла. Защита проекта
Химические украшения из металла. Защита проекта Презентация на тему Отравляющие вещества
Презентация на тему Отравляющие вещества  Лекция 1 Основные понятия и законы химии
Лекция 1 Основные понятия и законы химии Химические понятия. Вещество. Химические явления. Выдающиеся ученые-химики
Химические понятия. Вещество. Химические явления. Выдающиеся ученые-химики Кислород
Кислород Презентация на тему Интересные факты из жизни великого учёного Д. И. Менделеева
Презентация на тему Интересные факты из жизни великого учёного Д. И. Менделеева  Общая характеристика элементов группы, главной подгруппы
Общая характеристика элементов группы, главной подгруппы Химические явления. Горение. Презентация по природоведению для 5 класса Подготовила Шашлова Т.А.
Химические явления. Горение. Презентация по природоведению для 5 класса Подготовила Шашлова Т.А. allotropiya_fosfora_him._svoystva
allotropiya_fosfora_him._svoystva Спирты и фенолы
Спирты и фенолы Смолисто-асфальтеновые вещества
Смолисто-асфальтеновые вещества Наблюдения в сходящемся свете. Коноскопия
Наблюдения в сходящемся свете. Коноскопия атомно-молекулярное учение (1)
атомно-молекулярное учение (1) Химия жиров (липидов)
Химия жиров (липидов) Ароматические углеводороды. Бензол
Ароматические углеводороды. Бензол Гидролиз солей
Гидролиз солей Неметаллы
Неметаллы Цитология
Цитология Понятие о веществе. Свойства веществ
Понятие о веществе. Свойства веществ Аминокислоты. Классификация, номенклатура
Аминокислоты. Классификация, номенклатура Презентация на тему pH жидкостей, необходимых для человека
Презентация на тему pH жидкостей, необходимых для человека  Элементы и атомы, В менделеевский взяты круг Сделали химию самой богатой И самой творческой из наук.
Элементы и атомы, В менделеевский взяты круг Сделали химию самой богатой И самой творческой из наук. Bioenergetyka syntezy glutaminy
Bioenergetyka syntezy glutaminy Химические свойства воды
Химические свойства воды Получение азокрасителя в лабораторных условиях
Получение азокрасителя в лабораторных условиях Кислоты основания и соли как электролиты
Кислоты основания и соли как электролиты