Содержание
- 2. К Л А С С Ы Н Е О Р Г А Н И Ч Е
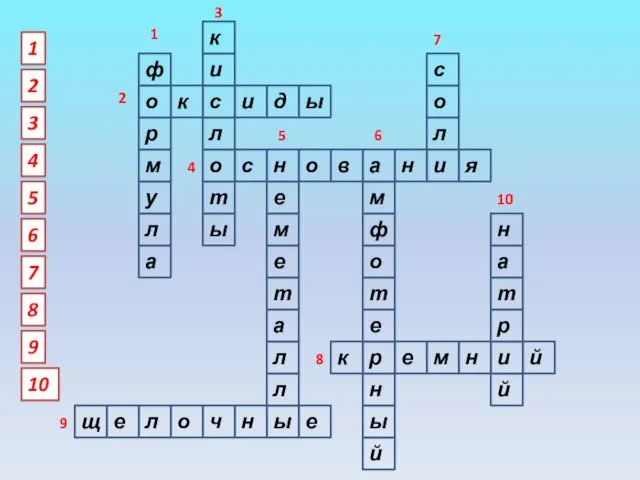
- 3. ф о р м у л а к с и д ы к и л о
- 4. 3. Вещества, окрашивающие индикаторы лакмус и метилоранж в красный цвет 2. Вещества из двух элементов, в
- 5. 9. Металлы 1 группы главной подгруппы 6. Характер оксида алюминия 7. Класс веществ, к которому относятся
- 6. Э Л Е К Т Р О Л И Т И Ч Е С К А
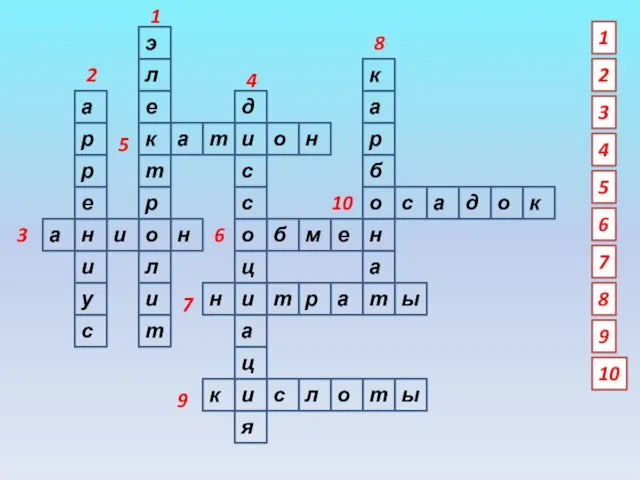
- 7. э л е к т р о л и т а т и о с а
- 8. 1. Вещество, способное в растворе или расплаве распадаться на ионы 2. Шведский ученый, разработчик положений теории
- 9. 10. Признак прохождения реакции обмена до конца 6. Тип реакции, в которую вступают два сложных вещества
- 10. Т Е С Т Ы Из четырех предложенных ответов выбрать один верный
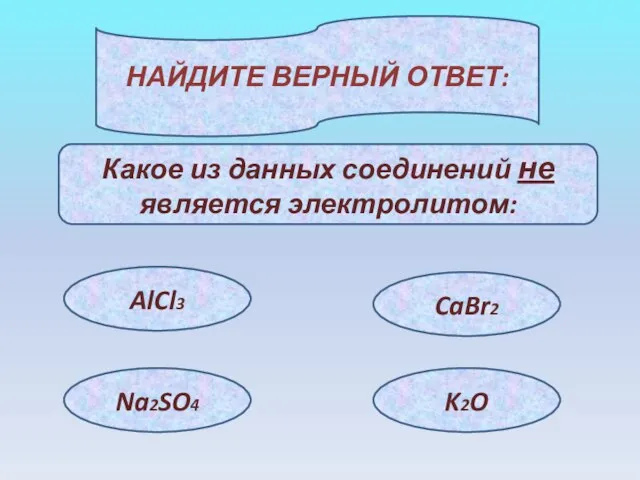
- 11. НАЙДИТЕ ВЕРНЫЙ ОТВЕТ: Какое из данных соединений не является электролитом: AlCl3 Na2SO4 CaBr2 K2O
- 12. НАЙДИТЕ ВЕРНЫЙ ОТВЕТ: Какое из данных соединений не является гидроксидом? Al(OH)3 Ba(OH)2 CaH2 NaOH
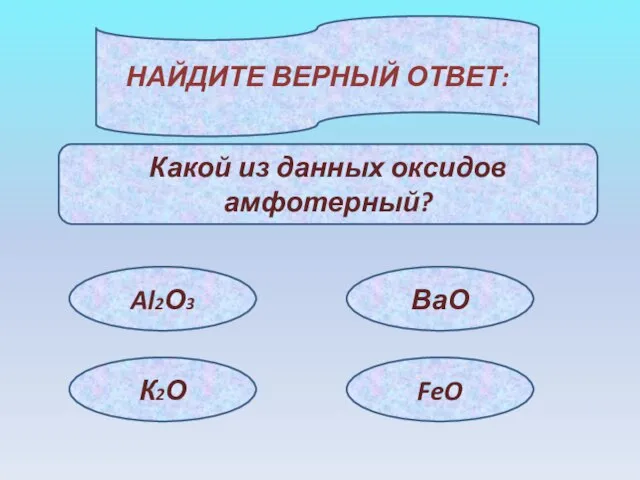
- 13. НАЙДИТЕ ВЕРНЫЙ ОТВЕТ: Какой из данных оксидов амфотерный? Al2О3 К2О ВаО FeO
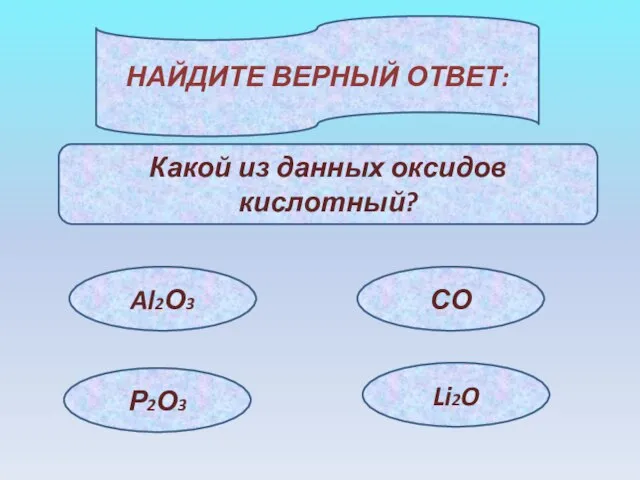
- 14. НАЙДИТЕ ВЕРНЫЙ ОТВЕТ: Какой из данных оксидов кислотный? Al2О3 СО Р2О3 Li2O
- 15. НАЙДИТЕ ВЕРНЫЙ ОТВЕТ: Какое из данных веществ проводит электрический ток? Al2О3 Na2O BaSO4 Li2SO3
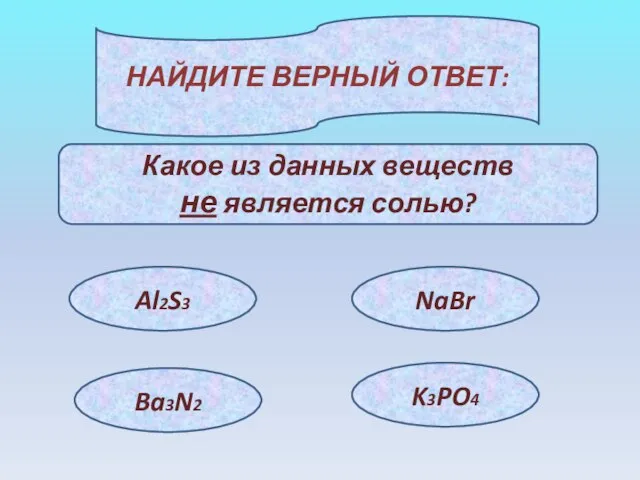
- 16. НАЙДИТЕ ВЕРНЫЙ ОТВЕТ: Какое из данных веществ не является солью? Al2S3 NaBr Ba3N2 K3PO4
- 17. НАЙДИТЕ ВЕРНЫЙ ОТВЕТ: Какой из данных оксидов вступит в реакцию с водой? Al2О3 Fe2O3 СаО ZnO
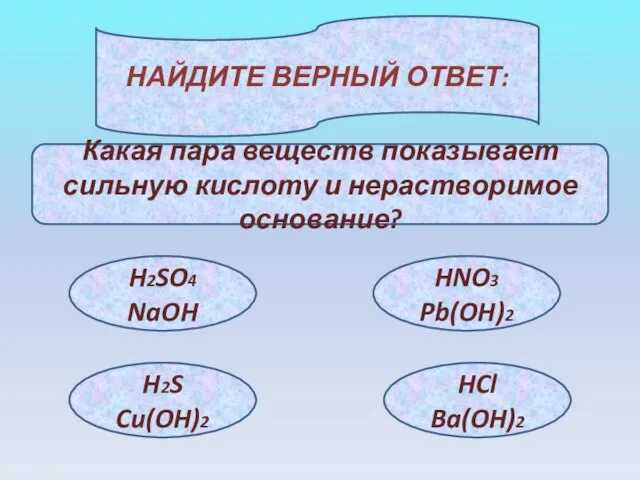
- 18. НАЙДИТЕ ВЕРНЫЙ ОТВЕТ: Какая пара веществ показывает сильную кислоту и нерастворимое основание? H2SO4 NaOH H2S Cu(OH)2
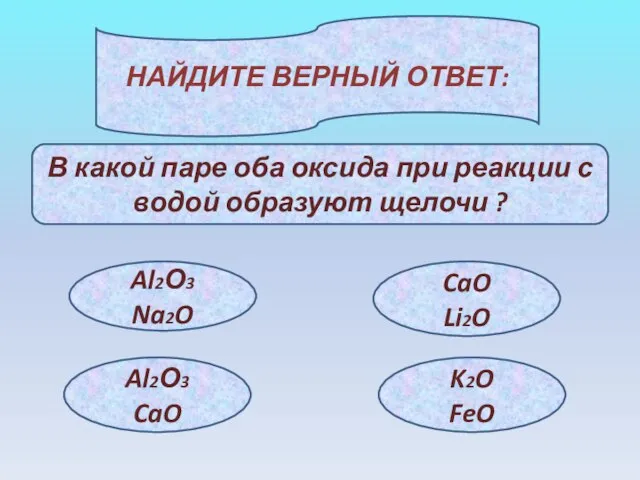
- 19. НАЙДИТЕ ВЕРНЫЙ ОТВЕТ: В какой паре оба оксида при реакции с водой образуют щелочи ? Al2О3
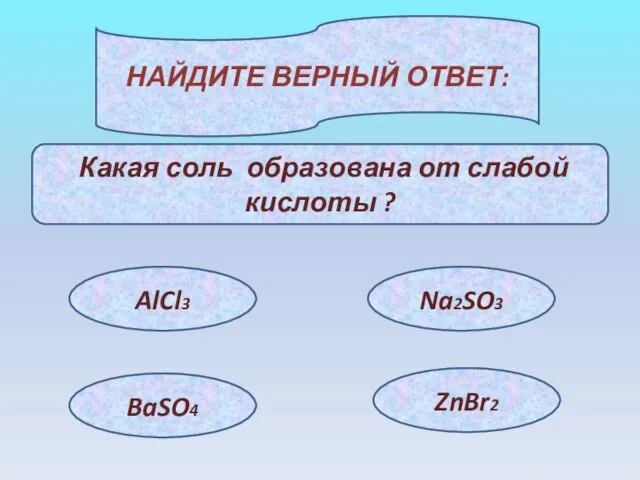
- 20. НАЙДИТЕ ВЕРНЫЙ ОТВЕТ: Какая соль образована от слабой кислоты ? AlCl3 BaSO4 Na2SO3 ZnBr2
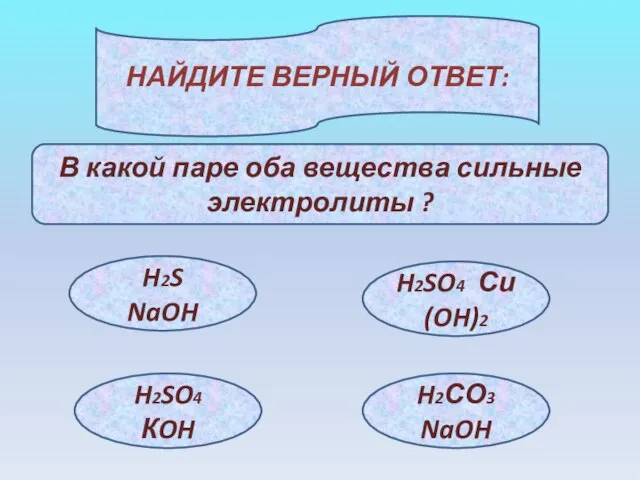
- 21. НАЙДИТЕ ВЕРНЫЙ ОТВЕТ: В какой паре оба вещества сильные электролиты ? H2S NaOH H2SO4 Си(OH)2 H2SO4
- 23. Скачать презентацию








 Технология производства и свойства химических волокон и тканей из них
Технология производства и свойства химических волокон и тканей из них Prezentatsia_k_uroku
Prezentatsia_k_uroku Валентность. Определение валентности по формулам
Валентность. Определение валентности по формулам 4505ab8713f54e72bb388461c5e134ac (1)
4505ab8713f54e72bb388461c5e134ac (1) Интеллектуальная игра по химии Металлы
Интеллектуальная игра по химии Металлы 175 – летию со дня рождения Дмитрия Ивановича Менделеева посвящается… АВТОР ПРЕЗЕНТАЦИИ: учитель химии МОУ СОШ №2 города Ртищево Саратовской области ПОПКОВА Е.Г.
175 – летию со дня рождения Дмитрия Ивановича Менделеева посвящается… АВТОР ПРЕЗЕНТАЦИИ: учитель химии МОУ СОШ №2 города Ртищево Саратовской области ПОПКОВА Е.Г. Химическая промышленность. 9 класс
Химическая промышленность. 9 класс Изучение ТЭД и ОВР в школьном курсе химии
Изучение ТЭД и ОВР в школьном курсе химии Определение формул органических веществ
Определение формул органических веществ Коррозионно-активное воздействие на РЭС. Оценка коррозионной стойкости. Лекция №11
Коррозионно-активное воздействие на РЭС. Оценка коррозионной стойкости. Лекция №11 Металлы в природе. Общие способы их получения
Металлы в природе. Общие способы их получения Избыток, недостаток. Решение задач
Избыток, недостаток. Решение задач Амфотерные гидроксиды
Амфотерные гидроксиды Получение и применение алкадиенов
Получение и применение алкадиенов Методические рекомендации по преподаванию учебного предмета Химия в 2021-2022 учебном году
Методические рекомендации по преподаванию учебного предмета Химия в 2021-2022 учебном году Аналитическая химия как наука. Лекция 1
Аналитическая химия как наука. Лекция 1 Химическая кинетика. Лекция 4
Химическая кинетика. Лекция 4 Основания. Классификация. Химические и физические свойства
Основания. Классификация. Химические и физические свойства Атомные спектры
Атомные спектры Каучуки, их история и виды использования
Каучуки, их история и виды использования Особенности ковалентной связи
Особенности ковалентной связи Металлическая химическая связь
Металлическая химическая связь Химические свойства кислот
Химические свойства кислот Техника безопасности на уроках химии
Техника безопасности на уроках химии Ионообменные материалы для сорбции биологически активных веществ
Ионообменные материалы для сорбции биологически активных веществ Nevarne snovi
Nevarne snovi Спирты. Классификация, изомерия спиртов. Физические и химические свойства спиртов
Спирты. Классификация, изомерия спиртов. Физические и химические свойства спиртов Понятие фазы вещества. Насыщенный пар и его свойства. Влажность воздуха. Приборы для измерения влажности воздуха
Понятие фазы вещества. Насыщенный пар и его свойства. Влажность воздуха. Приборы для измерения влажности воздуха