Содержание
- 2. Строение атома Заряд ядра атома +6 2 энергетических уровня 4 электрона на внешнем энергетическом уровне …2S22P2
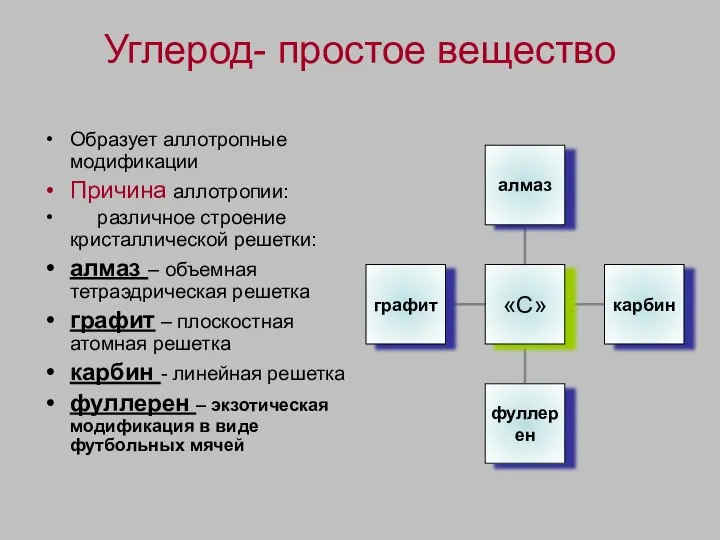
- 3. Углерод- простое вещество Образует аллотропные модификации Причина аллотропии: различное строение кристаллической решетки: алмаз – объемная тетраэдрическая
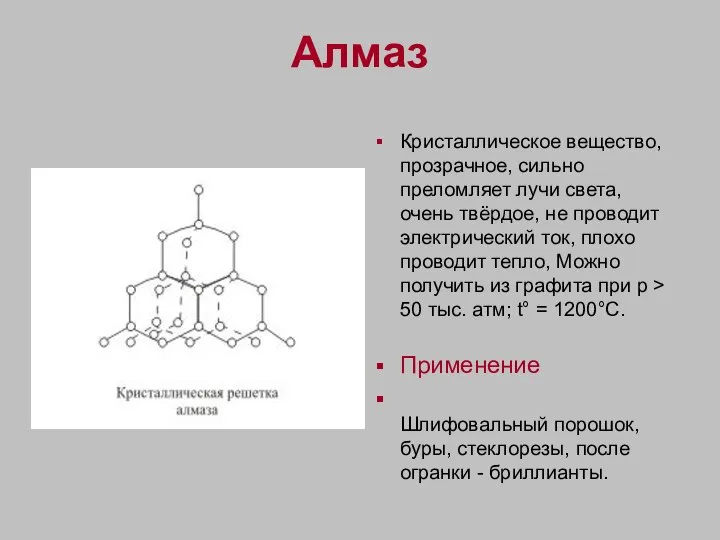
- 4. Алмаз Кристаллическое вещество, прозрачное, сильно преломляет лучи света, очень твёрдое, не проводит электрический ток, плохо проводит
- 5. Графит Кристаллическое вещество, слоистое, непрозрачное, тёмно-серое, обладает металлическим блеском, мягкое, проводит электрический ток; атомы углерода образуют
- 6. Карбин Чёрный порошок; полупроводник. Состоит из линейных цепочек –C≡C–C≡C– и =С=С=С=С= При нагревании переходит в графит.
- 7. Адсорбция Адсорбция - поглощение газообразных или растворённых веществ поверхностью твёрдого вещества. Обратный процесс - выделение этих
- 8. Интересная история, произошедшая с учеными М.Фарадеем и Г. Дэви Путешествуя, они остановились в одном замке, во
- 9. Химические свойства Углерод - малоактивен, на холоду реагирует только со фтором; химическая активность проявляется при высоких
- 10. Окислительные свойства с некоторыми металлами образует карбиды 4Al + 3C0 → Al4C3 Ca + 2C0 →
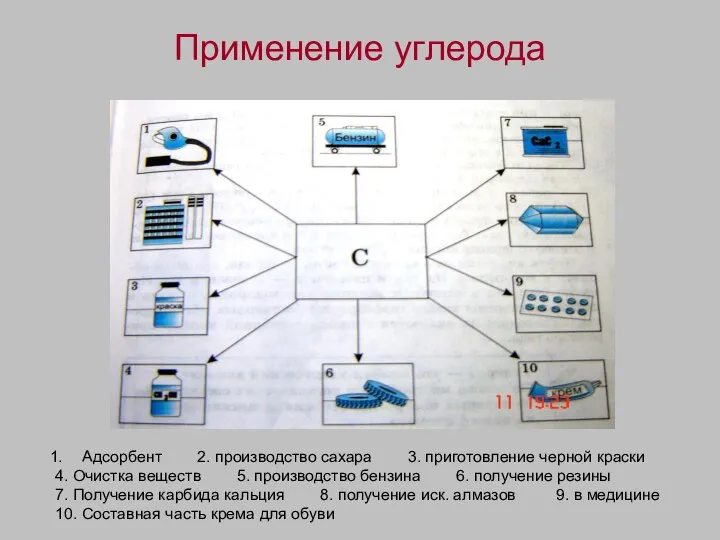
- 11. Применение углерода Адсорбент 2. производство сахара 3. приготовление черной краски 4. Очистка веществ 5. производство бензина
- 12. Соединения углерода Оксид углерода (II) CO Угарный газ; бесцветный, без запаха, малорастворим в воде, растворим в
- 13. Получение В промышленности (в газогенераторах): C + O2→ CO2 CO2 + C → 2CO В лаборатории
- 14. Химические свойства При обычных условиях CO инертен; при нагревании – восстановитель; несолеобразующий оксид. Взаимодействие с кислородом
- 15. Оксид углерода (IV) СO2 O=C=O углекислый газ, бесцветный, без запаха, растворимость в воде – в 1V
- 16. Получение оксида углерода (IV) Термическим разложением солей угольной кислоты (карбонатов). Обжиг известняка: CaCO3 → CaO +
- 17. Способы собирания:
- 18. Химические свойства оксида углерода (IV) Кислотный оксид: реагирует с основными оксидами и основаниями, образуя соли угольной
- 19. Угольная кислота и её соли Кислота слабая, неустойчивая, существует только в водном растворе: CO2 + H2O
- 20. Карбонаты металлов (кроме щелочных металлов) при нагревании разлагаются с образованием оксида: CuCO3 → CuO + CO2↑
- 22. Скачать презентацию
















 Стекло. Лекция №22
Стекло. Лекция №22 Химическая связь и ее типы
Химическая связь и ее типы Лёгкие металлы
Лёгкие металлы (+)-Plumisclerin A. Плюмисклин А
(+)-Plumisclerin A. Плюмисклин А Основные сведения о металлах и сплавах и их свойства
Основные сведения о металлах и сплавах и их свойства Побочная подгруппа VIII группы
Побочная подгруппа VIII группы Приходченко ФЕР-2031
Приходченко ФЕР-2031 Методы получения нафтиридинов (всех изомеров)
Методы получения нафтиридинов (всех изомеров) Тема: «Первоначальные сведения о строении вещества»
Тема: «Первоначальные сведения о строении вещества» Ковалентная полярная химическая связь
Ковалентная полярная химическая связь Химические свойства спиртов и фенола
Химические свойства спиртов и фенола Взаимное влияние атомов в молекулах
Взаимное влияние атомов в молекулах Основы химической термодинамики
Основы химической термодинамики Пименов_Химический состав
Пименов_Химический состав 28f89e0351fe4e509cc73515a12a26d5
28f89e0351fe4e509cc73515a12a26d5 lektsia_6 (1)
lektsia_6 (1) Экстракция
Экстракция Спирты
Спирты Строение атома. Экзаменационные вопросы
Строение атома. Экзаменационные вопросы Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота
Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота Лекция 3
Лекция 3 Тест по теме Альдегиды и кетоны
Тест по теме Альдегиды и кетоны Лекарственные средства – производные пиримидина
Лекарственные средства – производные пиримидина Активизация познавательной деятельности на уроках химии при работе с МГП (малыми графическими пособиями)
Активизация познавательной деятельности на уроках химии при работе с МГП (малыми графическими пособиями) Мутагены окружающей среды
Мутагены окружающей среды Пептиды, белки. Лабораторное занятие
Пептиды, белки. Лабораторное занятие Демокрит его вклад в развитие взглядов на строение вещества
Демокрит его вклад в развитие взглядов на строение вещества Презентация на тему Дисперсные системы и растворы
Презентация на тему Дисперсные системы и растворы