Содержание
- 2. «Здание, … громадное здание... Какая легкая архитектура …! Из чего эти двери и рамы окон? Что
- 3. Немного истории… . 1825 год. Ханс-Кристиан Эрстед, нагревая хлорид алюминия с амальгамой калия, выделил металлический алюминий
- 4. Химический элемент алюминий Задание 1: охарактеризуйте положение алюминия в периодической системе и строение его атома по
- 5. Проверьте себя: Задание 1: характеристика элемента алюминия по положению в периодической системе: I. Положение элемента в
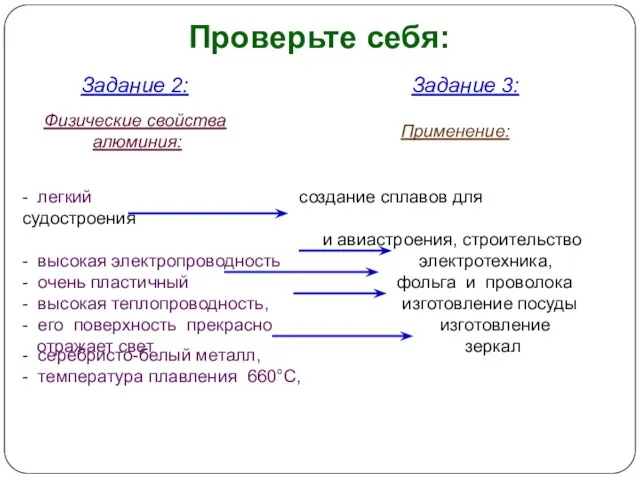
- 6. Физические свойства алюминия Внешний вид алюминия Задание 2: пользуясь учебником или другой справочной литературой, выпишите (в
- 7. - легкий создание сплавов для судостроения и авиастроения, строительство - высокая электропроводность электротехника, - очень пластичный
- 8. Химические свойства алюминия Алюминий — достаточно активный металл, но на воздухе мгновенно покрывается плотной пленкой оксида
- 9. Задание 4: Проверьте себя:
- 10. 2) Алюминий взаимодействует со сложными веществами: Б) со щелочами: Al + NaOH + H2O → Na[Al(OH)4]
- 11. Проверьте себя: Б) со щелочами: 2 Al + 2 NaOH + 6 H2O → 2 Na[Al(OH)4]
- 12. а) Алюминий реагирует с соляной и разбавленной серной кислотами Задание 6: напишите молекулярное, полное и краткое
- 13. Проверьте себя: Задание 6: Задание 7:
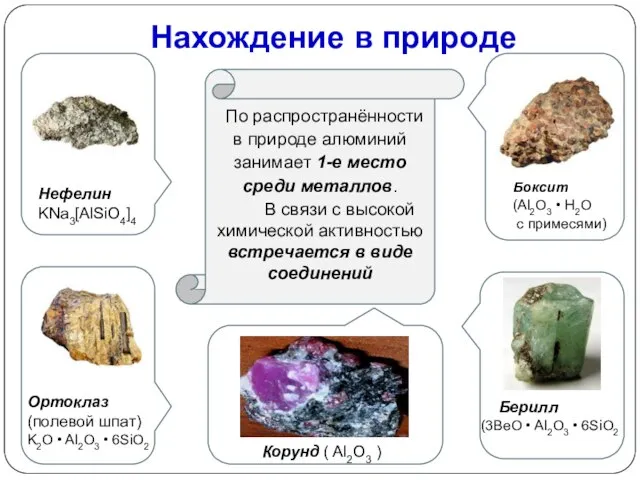
- 14. По распространённости в природе алюминий занимает 1-е место среди металлов. В связи с высокой химической активностью
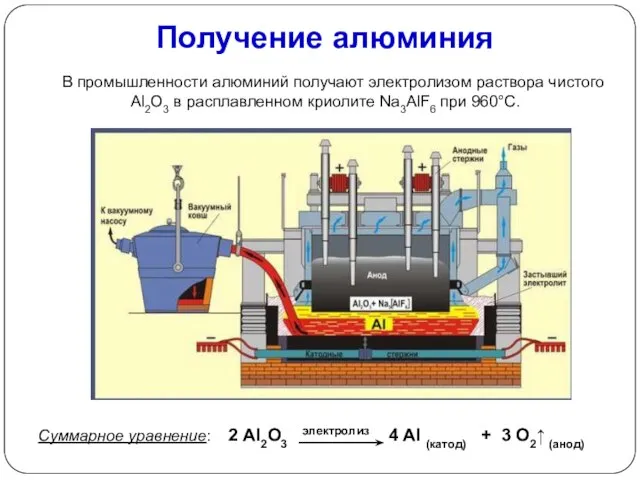
- 15. Получение алюминия В промышленности алюминий получают электролизом раствора чистого Аl2О3 в расплавленном криолите Na3AlF6 при 960°С.
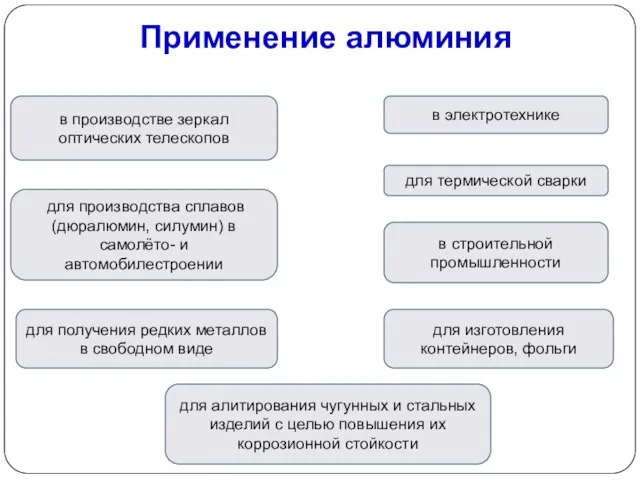
- 16. Применение алюминия в электротехнике в производстве зеркал оптических телескопов для производства сплавов (дюралюмин, силумин) в самолёто-
- 17. Применение сплавов алюминия Легкие, прочные и коррозионностойкие сплавы алюминия находят разнообразное применение транспорт в быту Нефтехимическая
- 18. Сплавы алюминия и транспорт Автотранспорт Железнодорожный Судостроение Авиация
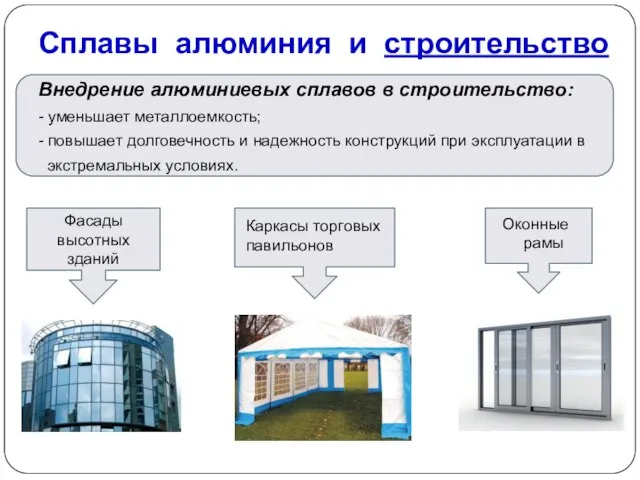
- 19. Сплавы алюминия и строительство Внедрение алюминиевых сплавов в строительство: - уменьшает металлоемкость; - повышает долговечность и
- 20. Алюминий и его сплавы в быту
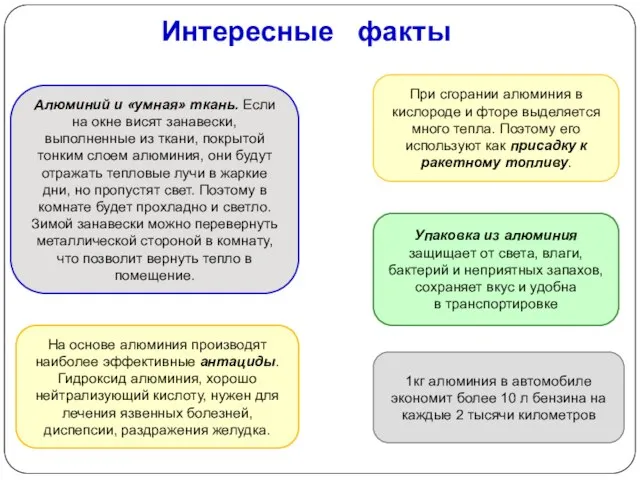
- 21. Алюминий и «умная» ткань. Если на окне висят занавески, выполненные из ткани, покрытой тонким слоем алюминия,
- 22. И в заключение … Постепенно из редкой диковинки, некогда ценившейся наравне с драгоценными металлами, алюминий превратился
- 24. Скачать презентацию















 Презентация по Химии "Законы газового состояния вещества"
Презентация по Химии "Законы газового состояния вещества"  Нуклеиновые кислоты
Нуклеиновые кислоты ТЭЦ, работающие на каменном угле более экологичны, чем на буром. Факт или вымысел?
ТЭЦ, работающие на каменном угле более экологичны, чем на буром. Факт или вымысел? Масляная кислота
Масляная кислота Азотосодержащие органические соединения
Азотосодержащие органические соединения Железо
Железо Башня плотности
Башня плотности Метаболизм липидов
Метаболизм липидов Презентация на тему Полисахариды. Крахмал и целюлоза
Презентация на тему Полисахариды. Крахмал и целюлоза  Потенциометрические анализаторы Поверка рН - метра
Потенциометрические анализаторы Поверка рН - метра Пересчет данных анализа, выраженных в ионной форме
Пересчет данных анализа, выраженных в ионной форме Синтез латексов
Синтез латексов Сухой спирт
Сухой спирт Презентация на тему Химические свойства оксидов
Презентация на тему Химические свойства оксидов  Бор и его соединения
Бор и его соединения Химическая кинетика. Экзаменационные вопросы
Химическая кинетика. Экзаменационные вопросы Строение электронных оболочек атома
Строение электронных оболочек атома Фосфор, строение, свойства
Фосфор, строение, свойства Биологически важные реакции монофункциональных соединений. Реакционная способность спиртов, фенолов, тиолов, аминов
Биологически важные реакции монофункциональных соединений. Реакционная способность спиртов, фенолов, тиолов, аминов Строение вещества
Строение вещества Номенклатура и изомерия аренов
Номенклатура и изомерия аренов Свойства аминов
Свойства аминов Презентация на тему Cкорость химических реакций
Презентация на тему Cкорость химических реакций  Строение и свойства этилена
Строение и свойства этилена Химические сплавы Cu
Химические сплавы Cu Group 6 Cations
Group 6 Cations ТЕСТ "Дисперсные системы"
ТЕСТ "Дисперсные системы" Презентация на тему Щелочные металлы
Презентация на тему Щелочные металлы